
Vol. 36, n.º 2, 2003
REVISTA
ESPAÑOLA DE
Vol. 36, n.º 2, 2003 |
Pascual Meseguer García1, María José Roca Estellés1, Francisco Sevilla Chica1, José Luis Martín Ruiz2, José Blas Gamón Pastor3, José Emilio Gómez Arce4, Álvaro Gómez Castro
Hospital Lluís Alcanyís. Xátiva. Valencia, diciembre de 2002. 1 Servicio de Anatomía Patológica. 2 Servicio de Medicina Intensiva. 3 Equipo de Atención Primaria de La Pobla Llarga. 4 Servicio de Medicina Interna. meseguer_pas@gva.es
DATOS CLÍNICOS
Dr. Martín: ANTECEDENTES: Se trata de un varón de 74 años que trabajó en el campo hasta los 27, después fue camionero hasta que se jubiló a los 65 años, no obstante continuaba haciendo esporádicamente trabajos agrícolas. Exfumador desde hace 2 años. Hipertenso de larga evolución, sin alergias conocidas. En 1980 se le practicó una vagotomía y una piloroplastia por úlcera duodenal. En el año 1990 ingresó por hemorragia digestiva alta, que se atribuyó a la toma de aspirinas por cefaleas y necesitó transfusión.
En el año 1995 ingresó en el hospital por descompensación de su disnea, la cual padecía desde hacía 5 años. Durante el ingreso presentó una reacción maculopapular y pruriginosa en la piel del tronco que cedió en menos de 24 horas. Refería padecer reacciones cutáneas de las mismas características desde años atrás. Fue diagnosticado de OCFA (obstrucción crónica del flujo aéreo) con un patrón mixto en las pruebas funcionales respiratorias, estadio funcional III/IV. Se le prescribió tratamiento con corticoides, los cuales ha estado tomando desde entonces; si bien ha tenido algunos intervalos libres de tratamiento en los periodos de mejoría.
Volvió a ingresar en el año 1995 por posible neumonía, en el hemocultivo se aisló Staphylococcus simulans. Posteriormente ha tenido varios ingresos por sobreinfección respiratoria y ha precisado oxígeno domiciliario en los dos últimos años de forma casi continua.
En uno de los ingresos presentó otra vez rash cutáneo abdominal que se atribuyó a la toma de betalactámicos. Se efectuó un nuevo hemocultivo, aislándose en esta ocasión Staphylococcus hominis hominis. En los análisis destacó una moderada anemia con leve linfopenia.
ENFERMEDAD ACTUAL: En abril de 2002 ingresó por un cuadro disnea, fiebre, cefalea y confusión. Se le hizo una TAC craneal: «Hipodensidad en la porción superior de la cisura de Silvio derecha, que podría corresponder a un área de isquemia antigua». Mejoró con tratamiento antibiótico y aunque no se pudo identificar el foco infeccioso se sugirió un origen pulmonar. Siete días más tarde se le dio el alta.
Ocho días después volvió a ingresar por disnea, la cual mejoró ostensiblemente con tratamiento específico. Durante su estancia estuvo con dolor abdominal y diarrea que alternaba con estreñimiento, por lo que se le hizo una radiografía simple de abdomen que fue compatible con íleo adinámico. Corrigiendo el sodio (que estaba bajo, 126 meq/L) y con enemas, también mejoró de los síntomas abdominales.
Estando en situación de ser dado de alta, comienza con disminución del nivel de conciencia, insuficiencia respiratoria y temblor de extremidades. Se decide el traslado a la UCI cuando llevaba 14 días ingresado.
Historia en la UCI: Ingresó con la sospecha diagnóstica de insuficiencia respiratoria reagudizada y coma carbónico (PH: 7,29, PCO2: 63 mmHg, bicarbonato: 30mmol/L). Llamaba la atención el importante broncoespasmo con atrapamiento aéreo. Se ventiló con bajo volumen y se le administró broncodilatadores y corticoides. En las primeras 24 horas se detectó orina piúrica y secreciones bronquiales purulentas, se tomaron muestras para cultivo y se inició el tratamiento con amoxicilina + ácido clavulánico. Los análisis revelaron anemia, que fue tratada transfundiendo dos concentrados de hematíes.
Seguía con episodios de diarrea alternando con estreñimiento pertinaz y distensión abdominal, por lo que se le realizó una ecografía abdominal que sólo demostró asas del intestino delgado poco móviles.
En el BAS y en la orina crecieron Enterobacter cloacae y Proteus penneri. En el hemocultivo Enterococcus faecium y Staphylococcus epidermidis. Se trató con ciprofloxacino según el antibiograma.
Después de unos días con ventilación mecánica, se detectó fiebre y una erupción cutánea localizada en abdomen, tipo púrpura palpable, de bordes irregulares, que no se asociaba a trombopenia ni a otros trastornos de la coagulación y tampoco se podía atribuir a los medicamentos que tomaba. Se practica biopsia de una de las lesiones y se cultiva.
En la radiografía de tórax había un patrón intersticial retículo-micronodular bilateral y edema subcutáneo (fig. 1).
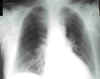
Fig. 1: Radiografía simple
de tórax. Patrón retículo-micronodular bilateral.
Se le realizó una punción lumbar, cuyo resultado fue compatible con una meningitis bacteriana y se cambió el antibiótico empíricamente por ceftriaxona y ampicilina. En el cultivo de LCR creció Enterococcus faecalis.
Ante la persistencia del coma después de varios días de tratamiento para la meningitis, se efectuó un EEG: «Trazado de amplitud muy reducida. Al aumentar la sensibilidad se aprecian ondas delta/subdelta de fondo. Arreactivo». Nos sugería una severa hipofunción de la actividad bioeléctrica cerebral que dentro del contexto podría ser compatible con una encefalitis. Se realizó de nuevo una TAC cerebral en la que no hubo hallazgos patológicos.
El cultivo de la piel fue negativo, la biopsia se informó de vasculitis leucocitoclástica con neutrófilos y eosinófilos.
El paciente empezó a deteriorarse por la aparición de varias infecciones nosocomiales (Candida albicans en orina, Stenotrophomonas maltophilia y Citrobacter freundii en BAS, diarrea por Campylobacter sp). Además, la púrpura no respondía a los corticoides y progresaba hacia el tórax y los miembros superiores.
En un intento de explicar la evolución clínica, se pensó que se podría tratar de un paciente inmunodeprimido por los corticoides, que había presentado una meningoencefalitis por enterococos y que al ser diagnosticado de forma tardía no había respondido bien al tratamiento.
Para buscar el foco primario, se realizó una ecocardiografía transesofágica en la que no se apreció ninguna verruga. Con el mismo fin se pidió una TAC abdominal: «Dilatación gástrica, de duodeno y asas de intestino delgado de hemiabdomen izquierdo, con nivel hidroaéreo en asas más altas. Las del hemiabdomen derecho son de calibre normal. Sin evidencia de masas que causen obstrucción» (fig. 2).
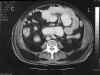
Fig. 2: TAC abdominal.
Dilatación de las asas intestinales del hemiabdomen izquierdo.
En los análisis destacaba una PCR de 132,3 MG/L, moderada anemia, leve linfopenia, hipoproteinemia e hiponatremia.
En los últimos días ha estado en situación de shock séptico dependiente de drogas y ha desarrollado un fracaso multiorgánico, falleciendo a los 20 días de su ingreso en UCI.
DISCUSIÓN
Dr. Gómez (Medicina Interna, moderador): ¿La evolución, se puede considerar típica de un paciente con OCFA?
Dr. Martín: No, la evolución ha sido totalmente atípica. A su ingreso en la UCI se pensó en un deterioro neurológico secundario a insuficiencia respiratoria global, probablemente por una sobreinfección. Aunque nos llamó la atención que, tratándose de un paciente en estadio funcional avanzado, corticodependiente y con oxigeno domiciliario, estuviera en coma con un valor de PCO2 no muy alto. Al no hallar otras causas metabólicas, ni encontrar focalidades, se mantuvo la hipótesis inicial.
Dr. Sevilla: ¿El Enterococcus faecalis es productor frecuente de meningitis?
Dr. Martín: No, de hecho, al principio pensamos que se trataba de una contaminación, reconsiderando la historia, lo relacionamos con los síntomas abdominales y pensamos que el foco primario estaría ahí.
Dra. Ferreruela (microbióloga): Son bacterias Gram negativas intestinales que provocan infecciones de mal pronóstico por lo que hay que tenerlas muy en cuenta.
Dra. Roca: ¿Qué pensáis que tenía en abdomen?
Dr. Vicent (Medicina Intensiva): Barajamos la posibilidad de un tumor, pero no se pudo visualizar con ninguna técnica radiológica. Se le determinó el CEA (antígeno carcinoembrionario) que también fue negativo.
Dra. Roca: ¿No tanteasteis otras posibilidades?
Dr. Vicent: Sí, que fuera alguna infección rara, por su situación de inmunodepresión. Se le pidió un coprocultivo que fue negativo y serología para hepatitis C y B, varicela, lúes y brucelosis. Todos resultaron negativos.
Dr. Canseco (Atención Primaria): ¿Se descartó el SIDA?
Dr. Martín: El VIH 1 y 2 también fueron negativos.
Dr. Gómez: Bien, si nadie quiere hacer otro comentario, vamos a pasar a ver la exposición del patólogo.
DATOS MORFOLÓGICOS
Dr. Meseguer: Es costumbre, en este tipo de sesiones, que los patólogos demos el diagnóstico al final, entre otras cosas para que no se nos vaya la audiencia. Yo me voy a atrever a decirlo ahora, con el anhelo de que la sesión no pierda su interés. El diagnóstico es... Diarrea de la Cochinchina... (Rumor en la sala)... Esta enfermedad fue descrita en 1876 por Louis Alexis Normand, un médico de la marina francesa. La describió en los soldados que venían de la Cochinchina, en aquella época era una colonia francesa situada en lo que hoy es el sur de Vietnam y de Camboya.
Seguidamente os voy a relatar cómo he llegado a este diagnóstico. Excepto los pulmones que tenían un peso tres veces superior a lo normal y un aspecto hemorrágico, los demás órganos no mostraban alteraciones macroscópicas.
Microscópicamente, había focos de bronconeumonía, en parte organizada, y en otras zonas hemorragia intraalveolar. Principalmente en los alvéolos, pero también en el intersticio, dentro de algunos bronquios y más raramente de los vasos sanguíneos, se podía ver unas estructuras ajenas al tejido pulmonar. Era a veces difícil descubrirlas, porque generalmente no provocaban reacción inflamatoria a su alrededor. Estas estructuras, que no pude verlas completas en ningún corte, las identifiqué como gusanos redondos, o sea, nematodos; o mejor dicho, larvas de nematodos (fig. 3).
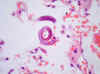
Fig. 3: Pulmón. Larva en un
alveolo, con la cola enroscada. En el corte no ha salido la región central. La
cápsula bucal está arriba a la izquierda (original, HE x600).
La tarea de ponerle nombre a este nematodo podía ser ardua, ya que los nematodos son el segundo phylum más numeroso del reino animal. Se cree que hay unas 500.000 especies, aunque hasta ahora sólo se han descrito unas 12.000; pero no se asusten, que pronto vamos a ir acotando el número. El 50% de los nematodos son especies marinas, el 25% vive libremente en el suelo o en el agua dulce, el 10% son parásitos de plantas y el 15% son parásitos de animales. Nuestro interés radica en los de este último grupo, de los cuales unos 130 tienen capacidad para parasitar a los humanos.
Podemos reducir más la lista, ya que hay pocos nematodos cuyas larvas puedan afectar al pulmón, estos son: Áscaris lumbricoides, Anquilostoma duodenal / Necator americanus (en adelante Anquilostoma), Strongyloides stercoralis, Toxocara canis y Toxocara cati (estos dos provocan la infección conocida como larva migrans visceral) y las filarias. Las últimas se pueden descartar porque son más pequeñas que las que nosotros hemos observado. Las larvas de Toxocara canis y Toxocara cati también las descartamos, porque nunca deberíamos verlas dentro de los bronquios como se ven en este caso. Por tanto nos quedaremos con las tres primeras, que son larvas de parásitos intestinales con fase de maduración obligatoria en el pulmón. Ya estamos estrechando el círculo sobre el escurridizo culpable. El siguiente paso puede ser concluyente porque podría descartar dos de ellos a la vez.
Resulta que las larvas filariformes del Áscaris tienen una diminuta ala en su cutícula externa a cada lado, mientras que las del Anquilostoma y del Strongyloides tienen dos. Busqué estas alas en los cortes transversales y me encontré con que tenían 2 a cada lado (fig. 4). Esto me sirvió para descartar el Áscaris (también me hubiera servido para descartar los Toxocara, que al fin y al cabo son los «Áscaris» de los perros y de los gatos).
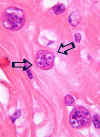
Fig. 4: Pulmón. Cortes
transversales de larva. Se pueden apreciar dos pequeñas alas a ambos lados
(flechas) (original, HE x1000).
Distinguir las larvas del Anquilostoma de las del Strongyloides en los cortes histológicos es prácticamente imposible. Con la mala evolución que ha tenido este paciente y teniendo en cuenta algunos datos clínicos, ya casi me atrevía a aventurar que se trataba de un Strongyloides; pero si queremos hacer «medicina basada en la evidencia» y los patólogos estamos obligados a ello en su acepción castellana, tenía que demostrarlo, o quedar en evidencia. Mi única esperanza era encontrar gusanos adultos. Tanto el Anquilostoma como el Strongyloides son parásitos intestinales, por lo que me dispuse a buscarlos en los cortes de intestino.
En la luz y dentro de las criptas del intestino delgado hallé hembras adultas de Strongyloides, que en los cortes transversales son un poco más gruesas que las larvas, con dos huevos a tensión en su interior que sólo dejan espacio para el tubo digestivo (fig. 5). Esta imagen histológica es diagnóstica de Strongyloides. La hembra del Anquilostoma estaría cargada de huevos idénticos, pero tendría un diámetro diez o quince veces mayor. Así pues, nos encontramos ante una estrongiloidiasis, que es el nombre apropiado con el que se conoce hoy día la diarrea de la Cochinchina.
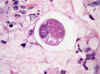
Fig. 5: Intestino delgado.
Corte transversal de hembra adulta con dos huevos y el tubo digestivo. Esta
imagen es específica del Strongyloides (original, HE x1000).
El siguiente paso fue ver si había más órganos afectados. En un primer examen de las laminillas que tenía no vi ninguna larva. Después de una nueva inclusión y de bastantes cortes seriados, encontré varias larvas en diversos órganos, como el hígado, el corazón (fig. 6), la piel y el tejido celular subcutáneo. En el riñón sólo vi una larva dentro de un glomérulo (figs. 7 y 8) y en el encéfalo, después de revisar muchos cortes, sólo vi dos, una en el mesencéfalo (fig. 9) y otra en el lóbulo frontal.
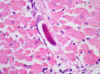
Fig. 6: Corazón. Larva en el
centro (original, HE x600).
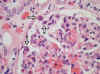
Fig. 7: Riñón. En el
espacio capsular se puede ver tres cortes transversales de una larva (original,
HE x600).
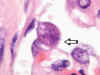
Fig. 8: Riñón. A más
aumento, en uno de los cortes de la larva se aprecia las dos pequeñas alas
laterales (flecha) (original, HE x1000).
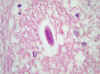
Fig. 9: Mesencéfalo. Larva
en el centro (original, HE x1000).
Las manifestaciones clínicas de la estrongiloidiasis dependen de la carga de parásitos, la mayoría de los pacientes son asintomáticos o presentan síntomas leves inespecíficos relacionados con los órganos que el parásito utiliza para su ciclo, que son: el tubo digestivo, la piel y el pulmón. Los síntomas suelen ser alguno de los siguientes: diarrea, indigestión, dolor abdominal, tos, disnea, cuadros pulmonares parecidos al asma o a la neumonitis del síndrome de Loeffler, y en la piel urticaria, rash, o «larva currens». En los análisis suele haber eosinofilia, anemia, hipoproteinemia y aumento de la IgE. Una adecuada inmunidad celular y sobretodo una respuesta satisfactoria de los eosinófilos es fundamental para mantener el parásito a raya.
Pero si se acelera la frecuencia de los ciclos, lo que ocurre generalmente en los pacientes inmunodeprimidos, se produce el síndrome de hiperinfección, en el cual los síntomas son más patentes. En el 5% de los casos la enfermedad progresa y el parásito afecta a otros órganos distintos a los que utiliza habitualmente en su ciclo, entonces se produce una infección diseminada, que es muy grave, con una mortalidad del 50-80%, incluso bien diagnosticada y tratada con antihelmínticos. En esta etapa se encontraba el paciente que nos ocupa.
El diagnóstico final es, por tanto, estrongiloidiasis diseminada en un paciente inmunodeprimido.
La causa de la muerte: Shock séptico por Stron gyloides stercoralis y bacterias Gram negativas.
A continuación os haré una breve reseña sobre el parásito. El Strongyloides es un geohelminto, vive en el suelo, no es un parásito obligado. Se han descrito 52 especies, una de ellas, el S. stercoralis, se ha especializado en parasitar al Homo sapiens, afectando actualmente a unos 70 millones en todo el mundo. Está distribuido ampliamente en las regiones tropicales y de forma esporádica aparecen casos en las zonas templadas. Hay otra especie, el S. fülleborni, que infecta a los monos y ocasionalmente también a los humanos.
El ciclo del Strongyloides stercoralis es el más complejo de todos los nematodos. Es el único nematodo, además del Capillaria philippinensis, que tiene la capacidad de reproducirse dentro del ser humano; pudiendo completar así el ciclo vital en el suelo o en el huésped independientemente.
El ciclo natural del gusano es el libre en la naturaleza: los huevos depositados por las hembras liberan larvas rabditiformes (no tienen capacidad para infectar); si las condiciones ambientales son idóneas, se transforman, después de varias mudas, en gusanos adultos, machos y hembras, que copulan, las hembras ponen nuevos huevos y se va perpetuando el ciclo. Pero la vida es dura, el gusano no siempre puede vivir agradablemente en el suelo; bien porque las condiciones climáticas se vuelven hostiles, bien porque escasea el alimento. Es un clásico en el ciclo del carbono (que es fundamental para el mantenimiento de la vida en la Tierra) la competición entre los hongos y los nematodos por los nutrientes. Esta desigual batalla se salda casi siempre con la victoria de los hongos, que han desarrollado muchas armas para eliminar a sus competidores; sirva como ejemplo el Arthrobotrys anchonia, que caza a los nematodos con lazos (fig. 10) o el Haptoglossa mirabilis, que lo hace lanzándoles una célula-arpón (fig. 11). Para librarse de enemigos tan temibles, algunos nematodos han desarrollado la capacidad de parasitar. El más sofisticado de todos es el Strongyloides.

Fig. 10: Nematodo capturado
por anillos constrictores, formados por 3 células que se hinchan en centésimas
de segundo, del hongo predador Arthrobotrys anchonia (microscopia electrónica
de barrido). Fotografiado por N. Allin y G.L. Barron, Universidad de Guelph,
Canadá.

Fig. 11: Célula-arpón del
Haptoglossa mirabilis. El proyectil se dispara insertándose en el nematodo, en
el que injerta esporas que crecen y consumen a la víctima. (Microscopia
Electrónica) Fotografiado por Jane Robb, Universidad de Guelph, Canadá.
Cuando las condiciones ambientales son adversas, las larvas rabditiformes se transforman en larvas filariformes, que tienen capacidad para penetrar la piel intacta; y comienza el ciclo parasitario: la larva filariforme penetra la piel, se introduce en los capilares irrumpiendo en el sistema circulatorio y es trasladada a los pulmones, penetra en los alvéolos y asciende a través del árbol bronquial hacia la faringe, es deglutida y sigue su camino hacia el intestino delgado donde se convierte en hembra adulta (no se han encontrado machos en el ciclo parasitario). Las hembras producen huevos por partenogénesis, que eclosionan muy pronto después de la puesta, liberando larvas rabditiformes. Estas larvas pasan a las heces y una vez evacuadas pueden seguir su ciclo de vida libre; pero algunas, que se transforman en infectivas (filariformes) antes de ser expulsadas, son capaces de provocar lo que se denomina autoinfección: las larvas filariformes penetran la pared intestinal o la piel perianal, alcanzan el sistema circulatorio, llegan al pulmón y de allí migran otra vez al intestino, completando el ciclo, que se puede mantener indefinidamente.
COMENTARIOS FINALES
Dr. Gómez: ¿Se puede decir que el paciente ha tenido la parasitosis desde que comenzó con los síntomas respiratorios?
Dr. Meseguer: Sí, con casi toda seguridad el paciente ha tenido la estrongiloidiasis durante los últimos 12 años, y probablemente la tenga desde joven.
Dr. Gamón: ¿Qué síntomas da la primera infección?
Dr. Meseguer: La primera infección por las larvas filariformes ocurre generalmente a través de la piel del pié. Suele pasar desapercibida, el paciente nota, tal vez, un ligero prurito que desaparece pronto. Este paciente se infectó seguramente trabajando descalzo en la huerta. Estas larvas (del latín larva, fantasma) son tan rápidas penetrando en los tejidos que han traído de cabeza a muchos investigadores, algunos, incluso, se han puesto larvas sobre su propia piel para demostrar el modo de contagio. Por ejemplo: en los años 50, un japonés, Tanaka, un poco escéptico (el modo de contagio estaba ya descrito desde principios del siglo XX), se puso 200 larvas sobre el brazo, describió exhaustivamente todos los síntomas, si bien estuvo a punto de morir.
Dr. Sevilla: El paciente seguramente sufría hipoacidez secundaria a la vagotomía ¿Pudo esta facilitar el contagio o el mantenimiento de la infección?
Dr. Meseguer: Hay algunos trabajos en los que se sugiere que una buena acidez gástrica cortaría el ciclo del parásito. De hecho, muchos de los pacientes con estrongiloidiasis son tomadores de antiácidos, lo que facilitaría que se perpetuase la infección; pero esta hipótesis no está bien estudiada, porque también se podría pensar que los tomaban por las molestias que les provocaba el parásito.
Dr. Gómez Castro (patólogo): ¿Qué es la «larva currens»?
Dr. Meseguer: Se llama así a la erupción que provocan las larvas cuando van avanzando bajo la piel. Es el síntoma que nos revela que está habiendo una autoinfección y es la única manifestación clínica patognomónica de la enfermedad. Son lesiones serpiginosas, sobreelevadas y pruriginosas, que aparecen en el tronco y se desplazan rápidamente, entre 5 y 10 cm/hora, desapareciendo las antiguas en pocas horas. No hay ninguna lesión cutánea de este tipo que se desplace tan rápidamente; por tanto, si esta lesión se sabe reconocer, es diagnóstica de la enfermedad.
Dr. Pastor (hematólogo): ¿Cómo estaban los eosinófilos en sangre y la IgE?
Dr. Martín: Los valores de los eosinófilos siempre fueron normales. La IgE se determinó una vez y fue de...lo tengo por aquí...519.3 UI/ML (valores normales entre 10 y 100).
Dr. Pastor: ¿Cómo interpretasteis el aumento de la IgE?
Dr. Martín: Además de las parasitosis, hay otras enfermedades en las que está aumentada, generalmente alérgicas o en el asma, de hecho el paciente tenía un atrapamiento aéreo que sugería un componente asmático.
Dra. Roca: La eosinofilia en este caso no estaba presente por el efecto de los corticoides, ya que estos disminuyen típicamente el número de eosinófilos y de linfocitos en la sangre.
Dr. Gómez: O sea, que este paciente estaba tomando el único medicamento que debería estar prohibido en la estrongiloidiasis.
Dr. Gómez Castro: Se puede decir que al tomar los corticoides la enfermedad se disparó. Es típico en esta enfermedad y hay muchos casos descritos. Los corticoides están mucho más implicados en la inducción de formas graves de la estrongiloidiasis que cualquier otra enfermedad que produzca inmunodepresión. Parece ser que dañan específicamente la inmunidad que nos protege de este gusano.
Dr. Canseco: Además, los corticoides, al evitar la eosinofilia, eliminaron uno de los datos que se utiliza para el diagnóstico.
Dr. Martín: Se ha dicho que un síntoma típico es la diarrea, pero en este caso quizá era un problema mayor el estreñimiento, además, con un extraño íleo paralítico.
Dr. Meseguer: La diarrea es un mecanismo de defensa que consigue eliminar las larvas rabditiformes antes de que se conviertan en infectivas. En estas infecciones en concreto, sería nefasto dar sólo un tratamiento sintomático. En los primeros estadios de la enfermedad hay diarrea; después, conforme van produciéndose episodios de autoinfección, al atravesar las larvas el intestino, dañan la pared, provocando fibrosis y rigidez y también dañan los plexos mioentéricos, por lo que el intestino pierde poder de contractilidad y se produce el íleo paralítico; lo que empeora la situación, porque da la oportunidad a muchas más larvas a convertirse en infectivas y volver a provocar autoinfección. También se ha sugerido que los corticoides actuarían sobre las larvas rabditiformes, probablemente por parecerse a alguna de las hormonas del gusano, acelerando la maduración hacia larvas filariformes.
Dr. Martín: ¿Se revisó la biopsia de la piel?
Dra. Roca: Si, y además de la vasculitis leucocitoclástica había un fragmento de larva entre el colágeno, sin reacción inflamatoria. En las biopsias de «larva currens» prácticamente no se ven nunca las larvas, pero esta vez si que estaba y se pasó por alto. Las lesiones cutáneas seguramente eran una mezcla compleja de vasculitis, rash y «larva currens». La vasculitis leucocitoclástica, desde luego, no es típica de esta enfermedad.
Dr. Canseco: ¿Entonces cómo se explica la vasculitis?
Dr. Roca: La vasculitis leucocitoclástica, también llamada alérgica o por hipersensibilidad, puede estar causada por medicamentos, infecciones o acompañar a otras enfermedades, si bien, casi la mitad de las veces no se descubre la causa. En este caso podría ser por sensibilización al parásito, no sería extraño, pero no conozco que esté descrito hasta ahora. Yo sugeriría que se debe a la sepsis bacteriana.
Dr. Tenías (Medicina Preventiva): ¿Por qué había tantas infecciones por Gram negativos?
Dra. Ferreruela: Las larvas, al atravesar el intestino, arrastran bacterias intestinales que pasan al torrente circulatorio y provocan infecciones en cualquier órgano, siendo la meningitis una de las clásicas y más graves.
Dr. Vicent: ¿Se ha dicho que el Enterobacter se asocia frecuentemente con el Strongyloides?
Dr. Meseguer: Creo que si hay una relación bastante estrecha.
Dr. Ferreruela: No, no, realmente cualquier bacteria que esté en el intestino puede ser causante de la sepsis. Las más frecuentemente descritas son Escherichia coli y Klebsiella.
Dr. Vicent: ¿En el cerebro se vio la meningitis o había encefalitis?
Dr. Meseguer: Meningitis aguda no, aunque quedaban pequeños focos de leve inflamación crónica en las meninges, un recuerdo de que efectivamente hubo una meningitis y el tratamiento fue efectivo. En la sustancia cerebral había microinfartos que contribuyeron a la sintomatología cerebral, además de que también había larvas.
Dr. Canseco: ¿Cuál es la frecuencia de estrongiloidiasis en nuestro medio?
Dr. Meseguer: No existen datos oficiales, que yo sepa. Este es el primer caso que hemos tenido en el servicio.
Dra. Ferreruela: Nosotros hemos visto otro caso hace poco. Lo detectamos porque vimos una larva moviéndose en un examen en fresco de sangre.
Dr. Gamón: Yo también tuve un caso, pero hace ya unos 10 años.
Dr. García (patólogo): Esta Parasitosis está muy asociada al cultivo de arroz y otros trabajos agrícolas que requieren estar con los pies en el agua o en el fango. En la comarca de La Safor, en la que tradicionalmente se ha cultivado arroz, hay muchos más casos. Hay quién la considera una zona endémica.
Dra. Tenías: Sí, pero hoy día se cultiva poco arroz en la zona y además se hace con maquinaria. El clima templado y la existencia de humedales en la zona seguramente crean un ambiente bueno para el desarrollo del gusano.
Dr. Escandón: Se ha hecho un estudio prospectivo en agricultores de La Safor y el 12 % estaba infectado. La mayoría varones de más de 50 años.
Dr. Meseguer: Yo he hablado con el Dr. David Rodríguez, del Centro de Salud de Oliva y me ha confirmado que en la comarca llevan unos 400 casos recogidos.
Dr. Gómez: La enseñanza del caso creo que es, que antes de dar corticoides debe uno asegurarse de que el paciente no padece una estrongiloidiasis.
Dr. Tenías: Quizá sólo a los que se les vaya a dar un tratamiento largo, porque en los tratamientos cortos no creo que a los corticoides les dé tiempo de dañar la inmunidad celular.
Dr. Escandón: Una buena anamnesis es fundamental antes de plantear un tratamiento con corticoides a largo plazo. Puesto que si es agricultor, ha trabajado en La Safor y tiene síntomas digestivos o cutáneos, podemos sospechar la enfermedad.
Dr. Sevilla: ¿Cuál sería el siguiente paso?
Dr. Tenías: Determinar los eosinófilos en sangre, que están aumentados en un 85%.
Dr. Meseguer: La eosinofilia suele faltar en las formas graves o cuando se esta tomando corticoides, como ha ocurrido en este caso.
Dra. Ferreruela: En un caso que se sospeche, se tiene que demostrar la larva en heces. Ya se ha dicho que la hembra pone huevos que se abren inmediatamente. Es el único nematodo que hace esto, así que si vemos larvas ya no nos planteamos otra parasitosis. Pero ver las larvas entraña cierta dificultad, porque la hembra pone sólo unos 60 huevos al día, en contraste por ejemplo con la del Anquilostoma que pone unos 20.000 al día. Por eso se deben tomar tres muestras en distintos días y se requieren procedimientos de aislamiento para separar las larvas infectivas de las no infectivas.
Sra. Carull (enfermera): ¿Qué precauciones debe tomar la familia y el personal sanitario para evitar el contagio?
Dr. Tenías: Evitar el contacto directo con las heces. Esto es importante, cuando el paciente tiene diarrea, si no controla bien los esfínteres y mancha las ropas. También está considerada enfermedad de transmisión sexual para los homosexuales masculinos.
Dr. Gómez: ¿Algún comentario o pregunta?
Dr. Gamón: Con el aumento de los viajes a países exóticos y de emigrantes que vienen de zonas tropicales, supongo que también importaremos los casos de esta enfermedad.
Dr. Meseguer: Sí, es una de las parasitosis más fácilmente importable, porque al tener capacidad el parásito para producir autoinfección, la enfermedad puede esta latente durante decenios. En las parasitosis por otros nematodos, sin embargo, cuando muere la hembra se acaba la infección. Por ejemplo la hembra del Áscaris vive 1 año y la del Anquilostoma de 6 a 8 años.
Dr. García: Se ha informado que la han desarrollado veteranos norteamericanos de la guerra de Vietnam, después de 40 años de haber vuelto del frente.
Dr. Ferreruela: ¿Conseguiste ver el parásito entero?
Dr. Meseguer: En los cortes histológicos no, y aunque ya no era necesario para hacer el diagnóstico tenía curiosidad por verlo, por eso ideé un experimento, que fue lavar con formol una muestra de intestino delgado que conservaba, y en el líquido encontré larvas (fig. 12), huevos y también una hembra (fig. 13).

Fig. 12: Larva sin teñir.
Obtenida por lavado intestinal. Mide 0,25 mm de longitud. Compárese con el
tamaño de los hematíes.

Fig. 13: Gusano hembra sin
teñir con huevos en su interior. Obtenida por lavado intestinal. No está
completa. Las hembras adultas miden 2,2 mm de longitud. El polo anterior del
gusano se encuentra abajo.
Dr. Gómez: En síntesis, este caso parece ser en todo el paradigma de la evolución de una estrongiloidiasis tratada con corticoides. ¿Algún otro comentario?
Dr. Meseguer: Me gustaría terminar con una cita novelística. De como Sherlock Holmes en Estudio en Escarlata le revela a su querido Dr. Watson uno de sus métodos deductivos, creo que guarda cierta semejanza con el procedimiento que seguimos al investigar una autopsia: «El gran factor, cuando se trata de resolver un problema es la capacidad de razonar hacia atrás. Ésta es una cualidad muy útil y muy fácil, pero la gente no se ejercita mucho en ella» «Confieso que no le comprendo» «No esperaba que me comprendiese. Veamos si puedo plantearlo de manera más clara. Son muchas las personas que, si usted les describe una serie de hechos, le anunciarán cuál va a ser el resultado. Son capaces de coordinar en su cerebro los hechos, y deducir que han de tener una consecuencia determinada. Sin embargo, son pocas las personas que, diciéndoles usted el resultado, son capaces de extraer de lo más hondo de su propia conciencia los pasos que condujeron a ese resultado. A esta facultad me refiero cuando hablo de razonar hacia atrás».
AGRADECIMIENTOS
Al Dr. George Barron, Universidad Guelph, Ontario, Canadá, por la cesión de las figuras 10 y 11.
A los doctores: Francisco García Herreros, Jorge Escandón Álvarez, José María Tenías Burillo, Pedro Manuel Canseco Graguera, Emilio Pastor Guzmán, Carlos Javier Vicent Perales y Rosa Ferreruela Vicente y a la Sra. Mercedes Carull Blasco, por su participación en la discusión.
Al personal de laboratorio del Servicio de Anatomía Patológica por su colaboración.
BIBLIOGRAFÍA
Cox FEG. History of Human Parasitology. Clin Microbiol Rev 2002, 15: 595-612.
Meyers WM, Connors DH, Neafie RC. Strongyloidiasis. En: Binford ChH, Connors DH editores. Pathology of Tropical and Extraordinay Diseases. Washington DC: Armed Forces Institute of Pathology; 1976. Vol 2, cap 6. p. 428-432.
Román P, Pastor A, Moreno S, Igual R, Martín A, Navarro I, Ricart C. Endemic strongylidiasis on the Spanish Mediterranean coast. Q J Med 2001; 94: 357-363.
Cremades MJ, Igual R, Ricart C, Estellés F, Pastor A, Menéndez R. Infección por Strongyloides stercoralis en la comarca de La Safor (Comunidad Valenciana). Med Clin (Barc) 1997; 109: 212-215.
Rodríguez D, Oltra C, Igual A, Parra F, Martínez J, Ángel C, Llario M, Sanjuán MT. Treinta casos de estrongiloidiasis en un centro de atención primaria: características y posibles complicaciones. Aten Primaria 1998; 21: 271-274.
Sir Arthur Conan Doyle. A study in scarlet. 1882.