
Vol. 40, n.º 4, 2007
REVISTA
ESPAÑOLA DE
Vol. 40, n.º 4, 2007 |
CASUÍSTICA
Rosario Serrano Pardo, Agustín Acevedo Barberá
Servicio de Anatomía Patológica de la Clínica Médico-Quirúrgica
Ruber. C/. Juan Bravo, 49. 28006 Madrid.
serranopr@yahoo.es
RESUMEN
El término meningioma cordoide fue usado por primera vez en 1988 para describir un tumor meníngeo que afectaba a individuos jóvenes y que se presentaba con anemia microcítica y/o disgammaglobulinemia. Presentamos un caso de esta variante poco frecuente, que corresponde a menos del 0,5% de todos los meningiomas. Corresponde a una mujer de 69 años sin otras patologías de interés. La lesión se manifestó con dolores de cabeza severos. La resonancia magnética cerebral mostró una masa tumoral supratentorial dependiente de meninge. Microscópicamente se evidenció una proliferación neoplásica dispuesta en lóbulos constituida por células epitelioides y fusiformes que mostraban vacuolización del citoplasma y que descansaban sobre una matriz mixoide, basófila. Las células tumorales expresaban antígeno epitelial de membrana (EMA) y no mostraban reactividad con proteína ácida glial fibrilar, proteína S-100 ni citoqueratina. La neoplasia fue diagnosticada de meningioma cordoide (grado II de la clasificación de la Organización Mundial de la Salud).
Palabras clave: Meningioma cordoide, sistema nervioso central.
SUMMARY
The term chordoid meningioma was first used in 1988 to describe a meningeal tumor among young people associated with microcytic anemia and/or dysgammaglobulinemia. We present a case of this rare variant, which comprises less than 0.5% of all meningiomas. A 69-yr-old female complained of severe headache with unremarkable physical examination. Brain magnetic resonance revealed a supratentorial tumoral mass with dependence of meninges. Histologically, the tumor mainly consisted of cords of vacuolated cells in an abundant myxoid and basophilic matrix. The tumor cells expressed epithelial membrane antigen (EMA) but not glial fibrillary acid protein (GFAP), S-100 protein or cytokeratin. The neoplasm was diagnosed chordoid meningioma grade II of the Word Health Organization (WHO).
Key words: Chordoid meningioma; central nervous system.
INTRODUCCIÓN
El término de meningioma cordoide fue propuesto por Kepes y colaboradores (1) en 1988 para describir un tumor meníngeo que afectaba a individuos jóvenes. Describieron 7 pacientes, con edades comprendidas entre 8 y 19 años, que presentaban unas neoplasias meníngeas con un peculiar patrón mixoide-cordoide, rodeadas de infiltrados linfoplasmocelulares masivos con formación de centros germinales. Los pacientes mostraban anemia microcítica hipocrómica resistente a tratamiento con hierro y en un paciente se describió, además, disgammaglobulinemia con retraso del crecimiento. Estos síntomas desaparecían al extirpar el tumor y volvían a aparecer en las recidivas tumorales (1). El tumor estaba compuesto de células con citoplasma vacuolado dispuestas en cordones sobre una matriz mixoide y se acompañaba a menudo de prominentes infiltrados linfoplasmocitoides peritumorales.
Posteriormente se han descrito más casos de meningioma cordoide (2-16) no asociados con alteraciones hematológicas que afectan tanto a edades pediátricas como a adultos. En la actualidad la clasificación de los tumores del sistema nervioso central de la OMS lo recoge como una variante poco frecuente de meningioma con mayor capacidad de recidiva. Presentamos un nuevo caso de meningioma cordoide del adulto, sin discrasia sanguínea asociada, y revisamos la literatura.
DESCRIPCIÓN DEL CASO
Mujer de 69 años sin antecedentes personales de interés que acudió a consulta porque desde hacía dos años presentaba dolores de cabeza frecuentes y severos. En el último mes refiere un episodio de pérdida de conciencia. El examen físico y neurológico no reveló alteraciones. Los parámetros hematológicos y bioquímicos fueron normales. En la tomografía axial computerizada del cerebro se observó una lesión isodensa en la región frontal parasagital derecha que con la resonancia magnética mostraba dependencia de meninge y comprimía el ventrículo lateral derecho. Se realizó una craneotomía frontal derecha para la resección del tumor. No se apreciaba invasión macroscópica del tejido cerebral adyacente y la masa se extirpó en su totalidad.
La pieza se remitió al servicio de Anatomía Patológica. Correspondía a una lesión polilobulada de superficie lisa y brillante, con fragmentos de dura en su superficie. Presentaba consistencia blanda y aspecto jugoso. En su conjunto medía 7,5 x 4 x 2,2 cm.
Microscópicamente se evidenció una proliferación neoplásica dispuesta en lóbulos constituida por células epitelioides y fusiformes que mostraban vacuolización del citoplasma y que descansaban sobre una matriz mixoide, basófila. La matriz se teñía con azul Alcián a pH 2. En algunas células se observaron pseudovacuolas intranucleares. En menos del 10% de la lesión se apreciaban focos de meningioma meningotelial clásico en forma de remolinos alrededor de pequeños vasos, sin cuerpos de psamoma (figs. 1 y 2). No se observó pleomorfismo nuclear, mitosis (2 mitosis por 20 campos de gran aumento) ni focos de necrosis. Tampoco se observaron criterios de meningioma atípico ni invasión cerebral.
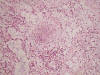
Fig. 1:
Cordones de células epitelioides sobre una matriz mixoide con focos de
diferenciación meningotelial típica (HE x100).
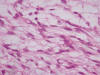
Fig. 2:
Las células muestran núcleos vesiculosos, con ocasionales pseudovacuolas, y
citoplasmas eosinófilos y vacuolados (HEx200).
Se realizaron técnicas de inmunohistoquímica con los siguientes anticuerpos comerciales prediluidos: EMA (Master Diagnóstica), citoqueratina de alto y bajo peso molecular (Master Diagnóstica), proteína ácida glial fibrilar (Master Diagnóstica), proteína S-100 (Dako), vimentina (Dako) y sinaptofisina (Master Diagnóstica). Las células neoplásicas mostraron positividad de membrana con EMA y difusa citoplásmica con vimentina. El resto de marcadores fueron negativos.
Con estos resultados el diagnóstico fue de meningioma cordoide.
El paciente no muestra recaída de su lesión transcurridos veintiún meses desde el diagnóstico.
DISCUSIÓN
El meningioma es un tumor intracraneal frecuente que ocurre sobre todo en la quinta y sexta décadas de la vida y que representa el 15% de los tumores primarios del sistema nervioso central (SNC) (17). El meningioma cordoide es una variante poco frecuente de meningioma con una incidencia del 0,5% de todos los meningiomas (3). Esta variante se recoge en la clasificación de los tumores del SNC de la OMS y es considerada como un grado II. Se describe como un tumor potencialmente agresivo, con capacidad para la recidiva local, a pesar de su apariencia histológica.
Ese término fue acuñado por primera vez por Kepes y colaboradores (1) para describir un tipo de meningioma con características histológicas similares al cordoma que afectaba a niños y jóvenes (con edades comprendidas entre 8 y 19 años), lo que contrasta con la baja incidencia de meningiomas en la edad pediátrica (17), y que se asociaba con el síndrome de Castleman (retraso del desarrollo sexual y somático, hepatoesplenomegalia, anemia microcítica/hipocrómica refractaria a hierro y disgammaglobulinemia) que desaparecía cuando se extirpaba la lesión. Posteriormente Kobata (18) y Civit (19) describen otros dos pacientes de 15 y 21 años respectivamente, con anemia microcítica. El caso publicado por Zuppan (4) es un paciente de 10 años con un gran tumor supratentorial que no mostraba manifestaciones sistémicas.
La mayor serie en la literatura es la de Couce (3) y colaboradores en la que se describen 42 casos de meningioma cordoide, con un rango de pacientes que comprenden edades entre los 12 y los 77 años. No recogen ningún caso asociado a alteraciones hematológicas o sistémicas pero como en su serie sólo describen dos casos en niños postulan que esta asociación pueda estar limitada a meningiomas cordoides de la infancia. Los casos publicados posteriormente (5-16) tampoco asocian alteraciones sistémicas con su lesión tumoral, con excepción de una mujer de 55 años con disgammaglobulinemia (20).
Todos los casos publicados coinciden en describir un tumor compuesto por células epitelioides, de citoplasma parcialmente vacuolado, formando cordones dentro de una matriz mixoide.
En los casos descritos por Kepes se describe un denso infiltrado linfoplasmocitario acompañando al tumor, compuesto en su mayor parte por células B y células plasmáticas. Esta no es una característica relevante en la serie de Couce, que sólo aparece en cinco pacientes, en los cuales se demuestra un predominio de células T. Se postula que tanto las células B como las células plasmáticas podían ser las causantes de las alteraciones sistémicas.
Dentro de los diagnósticos diferenciales se incluye entidades tumorales como el cordoma condroide (21), el condrosarcoma mixoide (22), el carcinoma mucoide y el glioma cordoide del tercer ventrículo (23). La identificación de áreas de componente de meningioma clásico así como la marcada reactividad con EMA de las áreas cordoides confirman el diagnóstico de meningioma cordoide. El cordoma es una lesión de la línea media cuyas células muestran positividad fuerte con citoqueratinas, EMA y proteína S-100. La reactividad con citoqueratinas diferencian al carcinoma. No existe ningún caso descrito de condrosarcoma mixoide en SNC. El glioma cordoide es una lesión recientemente descrita que guarda gran similitud histológica con el meningioma cordoide, incluso por la presencia de infiltrado linfoplasmocitario peritumoral. Se localiza en el tercer ventrículo e hipotálamo y no muestra dependencia de la dura meníngea. Muestra fuerte expresión de vimentina y de proteína ácida glial fibrilar y sólo positividad débil con EMA, proteína S-100 y citoqueratina.
La mayor serie descrita de meningioma cordoide (3) muestra una recidiva tumoral en el 39% de los casos, incluso hasta 16 años después de la extirpación quirúrgica. Todas las lesiones, excepto un caso, mostraban una resección subtotal. En la mayoría de los casos recidivados predominaba el patrón cordoide-mixoide con escaso componente inflamatorio. El índice de recidiva de estos tumores es significativamente mayor que el que se puede esperar de los meningiomas típicos con resección subtotal [7-20% según Perry y colaboradores (24)]. Una posible explicación a este hecho puede estar en relación, al igual que ocurre en el cordoma, con el estroma mucoide, que facilitaría mecánicamente la propagación local de las células neoplásicas y la subsiguiente recidiva tumoral.
En resumen, presentamos un nuevo caso de meningioma cordoide en un adulto, de localización supratentorial, sin alteraciones sistémicas asociadas. Nuestra revisión de la literatura confirma que el meningioma cordoide es un tumor que, aunque descrito inicialmente en pacientes jóvenes, es más frecuente en la edad adulta y sin alteraciones hematológicas o sistémicas asociadas. El diagnóstico diferencial debe hacerse principalmente con el cordoma condroide y con el glioma cordoide. El éxito curativo reside en la resección total de la lesión dada la gran capacidad de recidiva tumoral tras resección subtotal.
BIBLIOGRAFÍA
Kepes JJ, Chen WY, Connors MH, Vogel FS. Chordoid meningeal tumors in young individuals with peritumoral lymphoplasmacellular infiltrates causing systemic manifestations of the Castleman syndrome. A report of seven cases. Cancer 1988; 62: 391-406.
Glasier CM, Husain MM, Chadduck W, Boop FA. Meningioma in children: MR and histopathologic findings. AJNR 1993; 14: 237-41.
Couce ME, Aker FV, Scheithauer BW. Chordoid meningioma: A clinico-pathologic study of 42 cases. Am J Surg Pathol 2000; 24: 899-905.
Zuppan CW, Liwnicz BH, Weeks DA. Meningioma with chordoid features. Ultrastruct Pathol 1994; 18: 29-32.
Mori S, Oka K, Hakozaki H, Soga Y, Hayano M, Oka T, Nakazato Y, Mori N. Chordoid meningioma. A case report. Pathol Res Pract 2001; 197: 515-8.
Yano H, Shinoda J, Hara A, Shimokawa K, Sakai N. Chordoid meningioma. Brain Tumor Pathol 2000; 17: 153-7.
Kajiwara Y, Kodama Y, Hotta T, Kohno H. Taniguchi E, Yamasaki F, Katayama S, Yamane M. A case of chordoid meningioma. No Shinkei Geka 1999; 27: 957-1.
Mori S, Oka K, Hakozaki H, Soga Y, Hayano M, Oka T, Nakazato Y, Mori N. Chordoid meningioma. A Case Report. Pathol. Res. Pract. 2001; 197: 515-8.
de Tella OI, Herculano MA, Prandini MN, Stavile JN, Bonatelli AF. Chordoid meningioma. Report of two cases. Arq Neuropsiquiatr 2003; 61: 91-4.
Murali R, Ng T. Chordoid meningioma masquerading as chordoma. Pathology 2004; 36: 198-201.
Ozen O, Sar A, Atalay B, Altinors N, Demirhan B. Chordoid meningioma: rare variant of meningioma. Neuropathology 2004; 24: 243-7.
Soo MY, Ng T, Gomes L, Da Cruz M, Dexter M. Skull base chordoid meningioma: imaging features and pathology. Australas Radiol 2004; 48: 233-6.
Varma DR, Rao BR, Parameswaran S, Gupta AK, Joseph S, Radhakrishnan VV. Chordoid meningioma: a report of two cases. Neurol India 2003; 51: 522-4.
Yeon JY, Lee JI, Kim JH, Suh YL. Chordoid meningioma: a case report. J Korean Med Sci 2003; 18: 768-71.
Choi KC, Joo W, Jang KS, Kim MC. Chordoid meningioma: a case report. J Korean Neurosurg Soc 2005; 38: 390-2.
Mclver JI, Scheithauer BW, Atkinson JL. Deep sylvian fissure chordoid meningioma: case report. Neurosurgery 2005; 57: 1064-7.
Louis DN, Scheithauer BW, Budka H, von Deimling A, Kepes JJ: Meningiomas, in Kleihues P, Cavenee WK(eds), Pathology and Genetics of Tumours of the Nervous System. Lyon: IARC Press: 2000. p. 176-84.
Kobata H, Kondo A, Iwasaki K, Kusaka H, Ito H, Sawada S. Chordoid meningioma in a child. Case report. J Neurosurg 1998; 88: 319-23.
Civit T, Baylac F, TaillandierL, Auque J, Hepner H. Chordoid meningiomas. Clinical neuroradiologica and anatomopathological aspects. Neurochirurgie 1997; 43: 308-13.
Lee DK, Kim DG, Choe G, Chi JG, Jung HW. Chordoid meningioma with polyclonal gammopathy. Case report. J Neurosurg 2001; 94: 122-6.
Mierau G, Weeks DA. Chondroid chordoma. Ultrastruct Pathol 1987; 11: 731-7.
Cybulski GR, Rusell EJ, D Angelo CM, Bailey OT. Falcine chondrosarcoma: case report and literature review. Neurosurgery 1985; 16: 412-5.
Brat DJ, Scheithauer BW, Staugaitis SM, Cortez SC, Brecher K, Burger PC. Third ventricular chordoid glioma: a distinct clinicopathologic entity. J Neuropathol Exp Neurol 1998; 57: 283-90.
Perry A, Jenkins RB, Dahl RJ, Moertel CA, Scheithauer BW. Cytogenetic analysis of aggressive meningiomas. Possible diagnostic and prognostic implications. Cancer 1996; 77: 2567-73.