
Vol. 40, n.º 4, 2007
REVISTA
ESPAÑOLA DE
Vol. 40, n.º 4, 2007 |
REVISIONES
Jaime Prat Díaz de Losada1
Servicio de Anatomía Patológica. Hospital de la Santa Creu i
Sant Pau. Avda. San Antonio M.ª Claret, 167. 08025 Barcelona.
1 Catedrático de Anatomía Patológica. Universidad Autónoma
de Barcelona.
Jprat@santpau.es
RESUMEN
Los tumores borderline (llamados también tumores de bajo potencial de malignidad) tienen rasgos histológicos y citológicos intermedios entre los tumores claramente benignos y los claramente malignos. Muestran más proliferación epitelial que los tumores benignos correspondientes, pero no presentan invasión destructiva del estroma ni crecimiento sólido, y tienen mucho mejor pronóstico que los carcinomas. Aunque el término «borderline» podría sugerir un diagnóstico incierto, dicho término es sin duda el más apropiado porque describe precisamente los rasgos histológicos y biológicos ambiguos de estos tumores. En esta revisión se presentan los rasgos clinicopatológicos de los tumores ováricos borderline más frecuentes.
Palabras clave: Tumores ováricos, borderline, serosos, mucinosos, carcinoma intraepitelial, implantes peritoneales, pseudomixoma peritoneal.
SUMMARY
Borderline tumors (also designated as tumors of low malignant potential) show histologic and cytologic features that are intermediate between those of clearly benign and clearly malignant tumors of the same cell type(s); they exhibit epithelial proliferation greater than that seen in their benign counterparts but an absence of destructive invasion of the stroma, and are associated with a much better prognosis than that of ovarian carcinomas. Although the word «borderline» may suggest uncertainty, it accurately describes the ambiguous histologic and biologic features of these neoplasms and remains the most appropriate term. The clinicopathologic features of the most common types of ovarian borderline tumors are presented in this review.
Key words: Ovarian tumors, borderline, serous, mucinous, intraepithelial carcinoma, pseudomyxoma peritonei.
INTRODUCCIÓN
Los tumores ováricos epiteliales representan en nuestro medio aproximadamente el 65% de todos los tumores ováricos y el 90% de los cánceres de este órgano (1,2). Dichos tumores derivan directa o indirectamente del epitelio de la superficie ovárica (mesotelio) y del estroma subyacente. Según el tipo epitelial se clasifican en: serosos, mucinosos, endometrioides, de células claras, transicionales y escamosos. Sin embargo, su clasificación en tumores benignos, tumores borderline (de bajo potencial de malignidad) y carcinomas, es más importante desde el punto de vista clínico porque se corresponde con el pronóstico. Esta clasificación tiene en cuenta la proliferación celular, el grado de atipia nuclear y la presencia o ausencia de invasión del estroma (1,2). Sólo los tumores borderline serosos y mucinosos poseen rasgos clínicos y patológicos bien definidos.
Los tumores borderline (llamados también tumores de bajo potencial de malignidad) tienen rasgos histológicos y citológicos intermedios entre los tumores claramente benignos y los claramente malignos. Muestran más proliferación epitelial que los tumores benignos correspondientes, pero no presentan invasión destructiva del estroma ni crecimiento sólido y tienen mucho mejor pronóstico, estadio por estadio, que los carcinomas (2-4). Sin embargo, aun sin haber invadido el estroma ovárico, los tumores serosos borderline pueden implantarse en la superficie peritoneal o bien asociarse a focos independientes de neoplasia serosa del peritoneo y, rara vez, tanto unos como otros invaden los tejidos adyacentes (5-12). De forma excepcional, los tumores borderline se diseminan por vía linfática o hemática. Además, en raras ocasiones y tras un periodo de tiempo variable, pueden transformarse en carcinomas invasivos (9-11). Aunque en la mayoría de casos su pronóstico es favorable, su conducta biológica difiere notablemente de la de los tumores obviamente benignos del mismo tipo epitelial. Por ello, el término «tumor borderline» (o de bajo potencial de malignidad) debe mantenerse frente a otras denominaciones equívocas, tales como «tumores proliferativos» o «atípicos» (13). Dichas denominaciones no indican el potencial de malignidad de un pequeño pero significativo número de tumores borderline y desaconsejan la estadificación quirúrgica completa y el seguimiento de las pacientes (2-4,11). Aunque el término ‘borderline’ podría sugerir un diagnóstico incierto, dicho término es sin duda el más apropiado porque describe precisamente los rasgos histológicos y biológicos ambiguos de estos tumores.
La distinción entre tumores borderline y carcinomas constituye uno de los problemas más frecuentes de la patología ovárica; sin embargo, la literatura disponible sobre tumores borderline es confusa, sobre todo en lo que se refiere al diagnóstico y tratamiento. Para hacer el diagnóstico de carcinoma, la Organización Mundial de la Salud (OMS) (3) recomienda tener en cuenta la presencia o ausencia de invasión del estroma; sin embargo, cuando las células epiteliales del tumor muestran rasgos citológicos de malignidad, la mayoría de los patólogos no considera necesaria la presencia de invasión del estroma para establecer dicho diagnóstico. Con objeto de unificar la terminología, la OMS ha propuesto la incorporación de una variante histológica que se designa tumor borderline con carcinoma intraepitelial (2).
TUMORES SEROSOS BORDERLINE
Rasgos clínicos
Los tumores serosos borderline (TSB) representan el 25-30% de los tumores serosos potencialmente malignos (14,15). Ocurren más frecuentemente durante la 4.ª y 5.ª décadas y la edad media de las pacientes es de 42 años (10). Aunque suelen ser asintomáticos, pueden acompañarse de aumento del perímetro abdominal y dolor debido a torsión o ruptura. En aproximadamente 70% de los casos se encuentran localizados en uno o ambos ovarios (estadio I) en el momento del diagnóstico; en los casos restantes, el tumor se ha diseminado a la pelvis (estadio II) o a la parte superior del abdomen (estadio III). Sólo en muy raras ocasiones se presentan fuera del abdomen (estadio IV) (11,15). Los tumores son bilaterales en aproximadamente 30% de los casos (15).
Rasgos macroscópicos
Los TSB muestran uno o varios quistes revestidos por pólipos y papilas finas y cohesivas (crecimiento intraquístico) (fig. 1). Los quistes contienen líquido mucinoso sin que ello indique la naturaleza mucinosa del tumor. Los cistoadenofibromas borderline son de consistencia más firme y de aspecto blanquecino. En casi el 50% de los TSB se observan papilas en la superficie externa de los quistes y es frecuente la coexistencia de crecimiento exofítico e intraquístico (16). A diferencia de los carcinomas, los TSB no muestran zonas friables, hemorrágicas o necróticas.
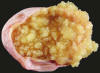
Fig. 1:
Tumor seroso borderline. Crecimiento
intraquistico de papilas finas, edematosas y cohesivas. Cortesía del Prof.
Jerónimo Forteza, Santiago.
Rasgos microscópicos
Tumores ováricos
Los TSB se caracterizan por glándulas y papilas revestidas por células epiteliales cúbicas o columnares y células ciliadas semejantes a las del epitelio tubárico (figs. 2 y 3). También se encuentran células de mayor tamaño (células «hobnail») con citoplasma eosinófilo abundante (fig. 4) y células de tipo mesotelial. El grado de atipia nuclear varía en un mismo tumor de leve a moderado (rara vez severo) y las mitosis son escasas; por tanto, el aspecto histológico de los TSB difiere del de los carcinomas «in situ» de otros órganos. En el 25% de los casos se encuentran cuerpos de psamoma. Los 3 rasgos diagnósticos más característicos son: a) papilas ramificantes que se hacen cada vez más finas y acaban formando nidos de células epiteliales que se separan del estroma (ramificación progresiva); b) atipia nuclear variable; y c) ausencia de invasión destructiva del estroma o de crecimiento sólido con arquitectura cribiforme (2).
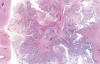
Fig. 2:
Tumor seroso borderline. Arquitectura típica. Las
papilas muestran ramificación compleja y progresiva sin invasión del estroma.
Algunas papilas muestran ejes conectivos edematosos.
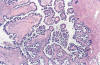
Fig. 3:
Tumor seroso borderline. Arquitectura típica. Las
papilas, cada vez más finas, acaban formando nidos de células epiteliales que se
separan del estroma. La atipia nuclear varia entre leve y moderada.
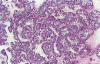
Fig. 4:
Tumor seroso borderline. La proliferación
compleja de glándulas y papilas no debe interpretarse como invasión del estroma.
Los TSB pueden mostrar ciertas variaciones morfológicas que dificultan su distinción de los carcinomas. Las más importantes se describen a continuación:
Arquitectura micropapilar.
Microinvasión.
Implantes peritoneales.
TSB en ganglios linfáticos.
TSB primario del peritoneo.
Arquitectura micropapilar
Los TSB pueden mostrar en raras ocasiones una proliferación micropapilar (o cribiforme) exuberante que no se acompaña de invasión del estroma (fig. 5). Algunos autores la describen con el término de «carcinoma seroso micropapilar» (no-invasivo) porque creen que tiene peor pronóstico que el TSB típico (17). Sin embargo, la mayoría de autores no comparte esta opinión y prefiere utilizar el término de «TSB micropapilar (o con arquitectura micropapilar) (8,10,11,18-20). Se trata de papilas finas (5 veces más largas que anchas) que nacen directamente de los tallos fibrosos y no se ramifican, lo cual confiere al tumor un aspecto en «cabeza de medusa» característico. Las papilas aparecen revestidas por células cúbicas no ciliadas con cociente núcleo-citoplásmico aumentado. El grado de atipia nuclear es leve y las mitosis son escasas (17). A diferencia de los TSB típicos, los micropapilares son más homogéneos y se caracterizan por una mayor proliferación de células epiteliales de aspecto uniforme. En casi todos ellos se encuentran áreas de TSB típico que, probablemente preceden a las micropapilares (17).
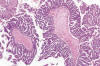
Fig. 5:
Tumor seroso borderline. Arquitectura
micropapilar en «cabeza de medusa». Se observa una filigrana de micropapilas (al
menos 5 veces mas largas que anchas) que nacen directamente de los ejes
conectivos. No se observa invasión del estroma.
Al menos 6 estudios recientes han demostrado que la supervivencia global de las pacientes con TSB micropapilar en estadio avanzado es prácticamente igual a la de las pacientes con TSB típicos en estadios semejantes (8,10,11,18-20). Los tumores micropapilares son más frecuentemente bilaterales, más a menudo exofíticos y se encuentran en estadios más avanzados (con implantes no invasivos) que los típicos; sin embargo, no se ha demostrado que dichos tumores se acompañen más frecuentemente de implantes peritoneales invasivos ni que tengan peor pronóstico. Aunque en 3 de los estudios referidos (10,18,19) se encontró una mayor asociación de los TSB micropapilares con implantes invasivos, la arquitectura micropapilar no afectó negativamente a la supervivencia cuando se agruparon los casos según el tipo de implantes. Estos hallazgos apoyan que el pronóstico de los TSB micropapilares se aproxima más al de los TSB típicos que al de los carcinomas.
Aunque los TSB micropapilares no suelen ser invasivos, a veces pueden contener focos de invasión del estroma; por ello, en estos casos debe tomarse un numero de muestras suficiente que permita excluir la presencia de invasión. Cuando la invasión del estroma es mayor de 10 mm2, se establece arbitrariamente el diagnóstico de carcinoma (véase microinvasión).
La arquitectura micropapilar indica un grado de proliferación epitelial mayor que el que se encuentra habitualmente en los TSB típicos y, por tanto, comparativamente más próximo al de los carcinomas serosos (2). Los estudios inmunohistoquímicos y mutacionales han demostrado que existen diferencias entre los 3 tipos histológicos (TSB típicos, TSB micropapilares y carcinomas serosos) (21). La inmunorreacción de P53 es débil y focal en los TSB típicos, moderada y difusa en los TSB micropapilares, e intensa en los carcinomas serosos. Por otra parte, las mutaciones de p53 sólo se encuentran en los carcinomas (aproximadamente en el 65%) (52). Estos hallazgos sugieren que los TSB micropapilares constituyen un grado de proliferación neoplásica intermedia entre los TSB típicos y los carcinomas serosos; la diferencia entre un TSB típico y un TSB micropapilar sería semejante a la que existe en el cérvix uterino entre un CIN-II y un CIN-III. Aunque la presencia de la arquitectura micropapilar en combinación con otros parámetros clínicos y patológicos (por ej. estadio avanzado, implantes peritoneales invasivos y microinvasión del estroma) puede asociarse a un mayor riesgo de progresión de la enfermedad, el aspecto micropapilar per se no representa un indicador de mal pronóstico (10).
Microinvasión
Aproximadamente el 10% de los TSB típicos contiene uno o más focos de microinvasión del estroma constituidos por células epiteliales aisladas o pequeños nidos de células con abundante citoplasma eosinófilo (fig. 6) (9-11,22-25). Los nidos aparecen a menudo rodeados por un halo claro que les separa del estroma. Los focos de microinvasión (no superiores a 10 mm2 de área o a 3 mm de diámetro mayor) no se acompañan de reacción del estroma y suelen pasar desapercibidos (2). La inmunorreacción para citoqueratinas ayuda a descubrirlos. Se encuentran más frecuentemente en las pacientes embarazadas (78).
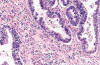
Fig. 6:
Tumor seroso borderline con microinvasión. El
estroma aparece infiltrado por células epiteliales aisladas y nidos de células
con abundante citoplasma eosinófilo.
Los TSB con microinvasión son más frecuentemente bilaterales, más a menudo exofíticos y se encuentran en estadios más avanzados que los TSB sin microinvasión; sin embargo, la frecuencia de implantes peritoneales invasivos es semejante en ambos (11). Al menos 5 estudios (9,11,22,24,25) han demostrado que los TSB con y sin microinvasión tienen un pronóstico semejante. Sin embargo, un estudio reciente ha sugerido que la microinvasión del estroma podría representar un factor de riesgo de progresión de la enfermedad independientemente del estadio y de la existencia de implantes peritoneales (10,23).
Implantes peritoneales
El aspecto más controvertido de los TSB es su asociación con implantes peritoneales que ocurre en el 30-40% de los casos (5-12). Los implantes se encuentran más frecuentemente en las pacientes cuyos tumores muestran crecimiento exofítico (16). Se trata sobre todo de lesiones microscópicas o macroscópicas de pequeño tamaño (≤1-2 cm). Su aspecto histológico varía considerablemente desde focos de epitelio glandular benigno semejantes a endosalpingiosis, papilas no invasivas, placas o nódulos de epitelio proliferativo y estroma, hasta implantes invasivos que recuerdan a un carcinoma seroso de bajo grado de malignidad (5). La endosalpingiosis, constituida por glándulas, quistes y ocasionalmente papilas con cuerpos de psamoma, es una lesión peritoneal benigna que suele acompañar a los TSB (fig. 7). Aunque podría representar un substrato propicio para el desarrollo de TSB o carcinomas del peritoneo, su presencia no cambia el estadio de un TSB ovárico sincrónico.
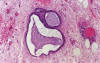
Fig. 7:
Endosalpingiosis. Las glándulas están revestidas
por epitelio aplanado de tipo tubárico.
Los implantes peritoneales de los TSB se clasifican histológicamente en no invasivos e invasivos y los no invasivos se subdividen en epiteliales y desmoplásicos (5). Los implantes no invasivos epiteliales muestran una proliferación papilar atípica semejante a la del tumor ovárico; se encuentran en la superficie peritoneal o en invaginaciones subperitoneales de contornos lisos y no se acompañan de reacción fibrosa del estroma (fig. 8) (5). Por el contrario, los implantes no invasivos desmoplásicos contienen sobre todo estroma fibroblástico inmaduro y sólo pequeños nidos de células epiteliales o glándulas (figs. 9 y 10). Aparecen en forma de placas bien definidas en la superficie peritoneal o rellenando intersticios entre los lóbulos de grasa del epiplon. Los implantes precoces muestran necrosis, hemorragia y depósitos de fibrina, mientras que los implantes viejos contienen escasos elementos epiteliales y cuerpos de psamoma rodeados de tejido fibroso denso con células inflamatorias (5). Los implantes invasivos sólo constituyen aproximadamente el 12% del total (5,8,10,11,19). Muestran infiltración irregular del tejido normal subyacente; por ejemplo, el epiplon (fig. 11). A diferencia de los implantes desmoplásicos, cuyos límites son bien definidos, los invasivos muestran límites irregulares; contienen mayor número de células epiteliales y se parecen a los carcinomas serosos de bajo grado de malignidad. Se denominan «implantes» (y no metástasis o carcinomas) porque se asocian a tumores ováricos no invasivos.
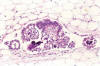
Fig. 8:
Implante epitelial no invasivo de tumor seroso
borderline entre los lóbulos de grasa del epiplon. La proliferación epitelial es
semejante al tumor ovárico y contiene cuerpos de psamoma.
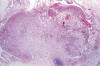
Fig. 9:
Implante desmoplásico no-invasivo de tumor seroso
borderline. Proliferación fibroblástica (tejido de granulación) bien
circunscrita con escasos nidos de células tumorales.
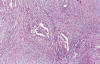
Fig. 10:
Implante desmoplásico no-invasivo de tumor seroso
borderline. El componente fibroblástico es más abundante que el componente
epitelial.
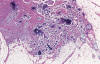
Fig. 11:
Implante invasivo de tumor seroso borderline. Las
glándulas y papilas muestran una distribución irregular y están rodeadas de
estroma fibroso denso («colágeno»). Muchas glándulas muestran un halo claro.
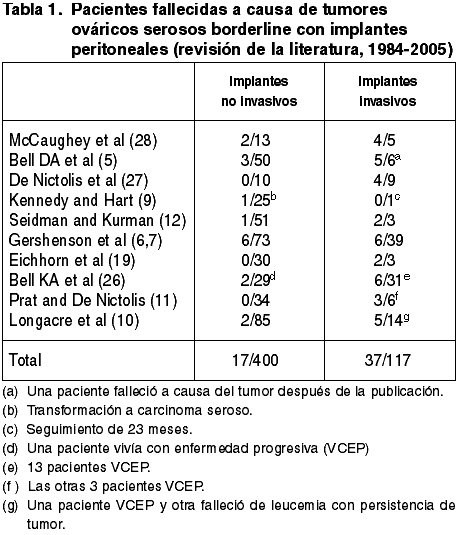
Al menos 10 estudios de TSB con implantes peritoneales (tabla 1) (5-7,9-12,19,26-28) han demostrado claramente que la separación de los implantes en invasivos y no invasivos tiene un valor pronóstico importante. En los raros casos de mal pronóstico, la mayoría de TSB se acompañaba de implantes peritoneales invasivos.
Implantes no invasivos epiteliales
Proliferación papilar similar a la del TSB ovárico.
En la superficie peritoneal o en invaginaciones peritoneales.
Márgenes bien definidos.
Ausencia de reacción del estroma.
Cuerpos de psamoma.
Implantes no invasivos desmoplásicos
Proliferación fibroblástica (estromal) en forma de placas peritoneales o entre lóbulos de grasa del epiplon.
Márgenes bien definidos.
Exceso de estroma fibroblástico (>50%) y escaso componente epitelial.
Hemorragia, necrosis (lesión precoz), fibrosis y calcificación (lesión tardía).
Implantes invasivos
Glándulas desordenadas con invasión destructiva del tejido normal.
Márgenes irregulares.
Abundante componente epitelial.
Estroma colágeno denso sin inflamación importante.
Semejantes a carcinomas serosos de bajo grado.
Aneuploidia.
Ciertos investigadores han sugerido que algunos «implantes» peritoneales asociados a los TSB ováricos representarían focos independientes de neoplasia primaria del peritoneo más que verdaderos implantes (29). Otros, sin embargo, teniendo en cuenta que el 65% de los TSB con componente exofítico se acompaña de implantes (frente a sólo el 5% de los exclusivamente intraquísticos) apoyan que se trata de implantes verdaderos (16).
Alteraciones genéticas somáticas
Los estudios genéticos recientes sugieren que los TSB y los carcinomas serosos convencionales de alto grado de malignidad son tumores con diferente patogénesis. Los TSB típicos y micropapilares contienen frecuentemente mutaciones de B-Raf/K-ras, pero muy rara vez mutaciones de p53. Por el contrario, las mutaciones de B-Raf/K-ras son raras en los carcinomas serosos convencionales, pero las mutaciones de p53 ocurren en aproximadamente 60% de los casos (30,31). Los perfiles de expresión de RNA en tumores serosos de ovario han demostrado que la vía mitogénica (RAS-RAF-MEK-ERK-MAP) cinasa se encuentra activada en los TSB; sin embargo, no tiene lugar la activación «downstream» de los genes que intervienen en la degradación de la matriz extracelular, lo que sugiere una desconexión entre ambos fenómenos (32). Dos genes reguladores supresores, Dusp-4 (inhibidor de ERK) y Serpina 5 (inhibidor de uPA), se encuentran infra-regulados en los carcinomas serosos pero no así en los TSB (32). Los perfiles de expresión de genes también han demostrado que en los TSB ocurre un aumento notable de la expresión de p53, del inhibidor de la cinasa dependiente de ciclina (CDK) p21, y de otros genes modulados por p53 (33). Estos hallazgos apoyan aun más que los TSB típicos y micropapilares y los carcinomas serosos (invasivos) de bajo grado de malignidad son neoplasias íntimamente relacionadas y distintas de los carcinomas serosos convencionales de alto grado de malignidad. Los carcinomas serosos invasivos de bajo grado de malignidad son raros, muestran arquitectura micropapilar y representan probablemente TSB con invasión destructiva del estroma que sobrepasa la microinvasión.
Mediante estudios de clonalidad se ha investigado si los TSB múltiples, sincrónicos o metacrónicos, que se encuentran en diferentes localizaciones abdominales (implantes peritoneales, ganglios linfáticos, etc), se deben a la diseminación de un único tumor ovárico primario o se trata más bien de lesiones policlonales correspondientes a tumores primarios peritoneales independientes. En un estudio reciente de implantes peritoneales invasivos y no invasivos y de metástasis ganglionares procedentes de 10 pacientes, se demostró concordancia de pérdidas de heterozigosidad (LOH) y de mutaciones de Raf/K-ras en 8 casos informativos en todas las localizaciones tumorales (34). Estos hallazgos apoyan la naturaleza metastática de los implantes peritoneales invasivos y no invasivos y de los depósitos tumorales en los ganglios linfáticos.
Conducta biológica
El pronóstico de los TSB es muy favorable. El riesgo de recidiva o de desarrollo de un segundo tumor en las pacientes con tumores en estadio I sólo es del 5-10% (9-11). Las recidivas son raras después de 10 años.
La mayoría de TSB que recidivan mantiene los rasgos microscópicos y el curso biológico indolente durante años sin progresar a carcinoma invasivo (9). No obstante, un estudio reciente ha indicado que la transformación a carcinoma seroso de bajo grado ocurre tardíamente en 6-7% de las pacientes y tiene mal pronóstico (10). Llama la atención que la mayoría (80%) de estas pacientes no había tenido implantes invasivos. Muy rara vez ocurre transformación a carcinoma de alto grado de malignidad precozmente (35), o después de varias recidivas (11).
TSB en ganglios linfáticos
Se desconoce la frecuencia exacta de afección de los ganglios linfáticos regionales en los TSB (fig. 12). En un estudio se encontró que los ganglios pélvicos, los para-aórticos o ambos estaban afectados en el 23% de los casos (36). Es muy probable que esta elevada frecuencia se deba a la inclusión de restos mullerianos (endosalpingiosis) que se encuentran ocasionalmente en las piezas de linfadenectomía realizada por otros motivos. Por tanto, es posible que algunos TSB se desarrollen en los ganglios linfáticos a partir de endosalpingiosis. Sin embargo, en las pacientes con TSB ováricos, la distinción entre tumor primario ganglionar y metástasis linfáticas puede resultar difícil. Cuando el tumor ganglionar se acompaña de endosalpingiosis posiblemente se ha originado a partir de ella. Por otra parte, cuando el tumor ocupa los senos vasculares, es muy probable que se trate de metástasis (2). Sin embargo, existe acuerdo en que la afección ganglionar no cambia el pronóstico favorable de las pacientes y no influye en el tratamiento. No obstante, un estudio reciente ha sugerido que la presencia de nódulos de células epiteliales (1-8 mm) acompañados de reacción fibrosa del estroma ganglionar se asocia a una reducción de la supervivencia libre de enfermedad (37). En raras ocasiones puede ocurrir afección de ganglios linfáticos extra-abdominales (11,38). Por último, en casos con implantes invasivos o en los que ha ocurrido transformación a carcinoma seroso de bajo grado de malignidad, puede haber sustitución extensa de los ganglios linfáticos por carcinoma que, obviamente, tiene mal pronóstico (97).

Fig. 12:
Tumor seroso borderline en ganglio linfático. Se
observa reacción fibrosa.
TSB del peritoneo
Los TSB pueden originarse raras veces en el peritoneo sin que se detecte afección ovárica concomitante (39,40). La edad de estas pacientes varía entre 16-67 (media 32) años y la mayoría presenta síntomas de esterilidad o dolor abdominal. No obstante, el tumor se descubre casualmente en aproximadamente la tercera parte de los casos (39). Las lesiones pueden ser focales o difusas y se presentan como adherencias fibrosas y granulares del peritoneo pélvico que se confunden con carcinomatosis. Histológicamente son semejantes a los implantes no invasivos de los TSB ováricos. El tratamiento estándar es la histerectomía con anexectomía bilateral y omentectomía. Las pacientes jóvenes pueden tratarse de forma conservadora (40). Aunque rara vez puede ocurrir la transformación a carcinoma seroso de bajo grado, el pronóstico es favorable (39).
Tratamiento
El tratamiento de los TSB es esencialmente quirúrgico. En las pacientes peri- o posmenopáusicas y en las que no desean concebir, el tratamiento estándar es la histerectomía y anexectomía bilateral. Además se realiza la estadificación convencional y la resección de todas las lesiones macroscópicas que se encuentren. En las mujeres jóvenes, con tumores unilaterales y ovarios contralaterales de aspecto normal que deseen conservar su capacidad reproductiva, puede realizarse una ooforectomía unilateral o incluso una cistectomía (9,41,42). Aunque algunos autores consideran que la práctica de una estadificación reglada en estos casos es un procedimiento demasiado radical, otros recomiendan su realización en pacientes con TSB aparentemente en estadio I con objeto de excluir la presencia de implantes peritoneales (43). En un estudio reciente, el 16-30% de los TSB considerados inicialmente en estadio I y el 75% de los que se creía en estadio II, se clasificaron como estadio III tras la re-estadificacion (43). Se recomienda el seguimiento de las pacientes con TSB. Aunque se ha aconsejado la realización de la histerectomía y salpingo-ooforectomía contralateral una vez completa la descendencia, su utilidad ha sido puesta en duda (44). En las pacientes que desarrollan un tumor semejante en el ovario contralateral (5-10% de los casos), el tratamiento exclusivamente quirúrgico suele resultar eficaz (9,11). En los estadios avanzados, la actitud postoperatoria varía entre el seguimiento de las pacientes sin aplicar tratamiento adicional alguno y la administración de quimioterapia. En estos casos no se ha demostrado que el tratamiento adyuvante altere el curso de la enfermedad y, desgraciadamente, muchas pacientes han fallecido a consecuencia de las complicaciones del mismo (9). Actualmente se recomienda la administración postoperatoria de quimioterapia (carboplatino y paclitaxel) a las pacientes con implantes peritoneales invasivos o no invasivos pero con enfermedad macroscópica residual (9,45). En las pacientes con TSB recidivantes, la cirugía citorreductiva y la resección óptima se ha asociado a una elevada supervivencia global (46).
Pronóstico
La supervivencia de las pacientes con TSB es mucho mayor que la de las pacientes con carcinomas. Según el informe anual más reciente (2003) de la Federación Internacional de Obstetricia y Ginecología (FIGO) (47), las tasas de supervivencia a los 5 años para las pacientes con TSB en estadios I a IIIb oscilan entre el 88% y más del 95%, mientras que la correspondiente a los estadios IIIC o IV se aproxima al 60%. Se estima que la supervivencia a los 20 años es aproximadamente del 80%. Con excepción de los implantes invasivos, no existe acuerdo en la literatura en lo que se refiere a factores pronósticos. La citología peritoneal positiva no tiene valor predictivo de supervivencia en las pacientes con TSB (48). La mayoría de autores cree que los TSB micropapilares tienen un pronóstico semejante al de los TSB típicos. Asimismo, no se ha demostrado que la afección de los ganglios linfáticos influya en la supervivencia. La mayoría de los TSB contiene ADN diploide. Los TSB aneuploides tienen peor pronóstico (48).
TUMORES MUCINOSOS
Los tumores mucinosos representan el 10-15% de todos los tumores ováricos (14). Cerca del 80% son benignos y el resto tumores borderline y carcinomas (14). Aunque los tumores mucinosos borderline y los carcinomas mucinosos ocurren sobre todo en mujeres de edad avanzada (edad media 51-54 años), son más frecuentes durante las primeras dos décadas de la vida que los tumores serosos correspondientes (2). La clasificación de los tumores mucinosos de ovario ha cambiado notablemente durante los últimos 50 años debido a: 1) la separación de los tumores mucinosos borderline de los carcinomas mucinosos; 2) la introducción de una variante de tumor mucinoso borderline con carcinoma intraepitelial; 3) la observación de que la mayor parte de los tumores mucinosos quísticos de ovario asociados a pseudomixoma peritoneal son en realidad metástasis de origen apendicular; y 4) el reconocimiento cada vez mayor de las metástasis de los adenocarcinomas intestinales y pancreáticos que, hasta hace poco tiempo, se confundían con tumores mucinosos ováricos, tanto borderline como carcinomas.
Los tumores ováricos mucinosos se clasifican en benignos, borderline y malignos dependiendo del grado de proliferación celular, la atipia nuclear y la presencia o ausencia de invasión del estroma. A diferencia de los tumores serosos, que son típicamente homogéneos, los mucinosos son frecuentemente heterogéneos. En un mismo tumor pueden coexistir componentes benignos, borderline e invasivos. Además, no es infrecuente que el componente maligno varíe desde carcinoma no invasivo a invasivo y de carcinoma bien diferenciado a mal diferenciado o incluso carcinoma anaplásico. Este espectro morfológico sugiere la existencia de progresión tumoral desde el cistoadenoma y el tumor borderline hasta el carcinoma intraepitelial, microinvasivo e invasivo. Los estudios mutacionales del oncogén K-ras apoyan esta hipótesis. Los tumores mucinosos borderline tienen mayor frecuencia de mutaciones K-ras que los cistoadenomas mucinosos y menor que los carcinomas mucinosos (49,52). Desde un punto de vista práctico, la evaluación pronóstica de los tumores mucinosos borderline es difícil por su gran tamaño y por la gran variabilidad en el grado de diferenciación de un mismo tumor; por ello es necesario examinar numerosas muestras histológicas y prestar especial atención a las áreas sólidas.
Tumores mucinosos borderline
Los tumores mucinosos borderline (TMB) o de bajo potencial de malignidad muestran un grado de proliferación celular mayor que el de los cistoadenomas mucinosos benignos pero no muestran invasión destructiva del estroma. En nuestro medio son menos frecuentes que los TSB y más que los carcinomas mucinosos (53). Los TMB se clasifican en dos tipos clinicopatológicos diferentes: intestinales (85% de los casos) y endocervicales (15%) (54).
Tumores mucinosos borderline de tipo endocervical
Los TMB de tipo endocervical (TMBE) (54), llamados también TMB mullerianos, constituyen el 10-15% de los TMB. Se han descrito cerca de 140 casos (54-57). Estos tumores se diferencian de los TMB de tipo intestinal en varios aspectos clínicos y patológicos tal y como se muestra en la tabla 2. La edad media de las pacientes es de 40 años y varía entre 15 y 84 años (54-57). Se asocian frecuentemente con endometriosis. La diseminación peritoneal o a los ganglios linfáticos ocurre en aproximadamente el 20% de los casos (54). No se asocian con pseudomixoma peritoneal.
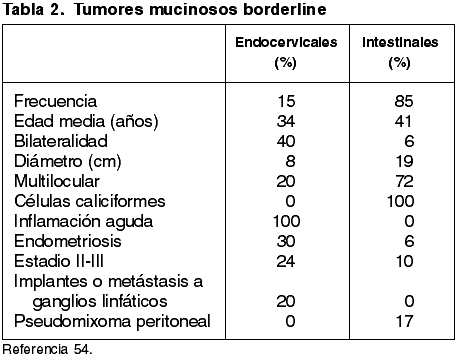
Rasgos macroscópicos
El tamaño medio de los tumores es de 8-10 cm y varía entre 2 y 36 cm. En el 80% de los casos se trata de quistes uniloculares. La mayoría muestra papilas intraquísticas macroscópicamente visibles. Son bilaterales en 12-40% de los casos (54-57) y el ovario contralateral desarrolla más tarde un tumor semejante en el 7% de los casos (54).
Rasgos microscópicos
Los tumores contienen papilas complejas semejantes a las de los TSB (fig. 13). Las papilas se encuentran revestidas por células epiteliales columnares que contienen mucina y son similares a las de las glándulas endocervicales. También se encuentran células indiferentes con citoplasma eosinófilo (54). Los núcleos muestran atipia leve y las mitosis son infrecuentes. No se observa invasión destructiva del estroma. La estratificación de las células epiteliales puede alcanzar 20 hileras de núcleos o más sin que ello constituya evidencia de malignidad (54). También pueden encontrarse otras células epiteliales de tipo mulleriano tales como células serosas ciliadas, endometrioides y escamosas. No se observan áreas de diferenciación intestinal. La infiltración de leucocitos polimorfonucleares ocurre prácticamente en todos los casos.
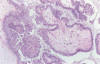
Fig. 13:
Tumor mucinoso borderline de tipo endocervical.
La arquitectura papilar es semejante a la del tumor seroso borderline. Sin
embargo, las papilas están revestidas por células epiteliales mucosecretoras con
estratificación focal. Se observa la característica infiltración de leucocitos
polimorfonucleares.
Recientemente se han descrito TMBE con carcinoma intraepitelial (55-57). Entre los rasgos microscópicos del carcinoma intraepitelial figuran: arquitectura cribiforme, papilas desprovistas de estroma y características nucleares de malignidad. Los focos de carcinoma intraepitelial suelen ser múltiples y miden 1-2 mm de diámetro. Diez pacientes con TMBE con carcinoma intraepitelial se encontraban libres de enfermedad 7 años después (55-57).
También se ha descrito la presencia de microinvasión del estroma en 24 TMBE (19%) procedentes de 5 series distintas (24,55-58). Los focos microinvasivos medían entre <2 y 5 mm de diámetro mayor y eran semejantes a los que se encuentran en los TSB. Doce pacientes se encontraban libres de enfermedad después de un tiempo medio de 8 años (24,55,56,58).
Los TMBE se acompañan de implantes pélvicos o abdominales en el 3-20% de los casos. En algunos casos los implantes pueden originarse en focos independientes de endometriosis. Algunos implantes pueden tener aspecto invasivo.
Tratamiento y pronóstico
Los TMBE en estadio I se tratan como los TSB. Cuando se conserva el ovario contralateral, se recomienda seguir a la paciente porque puede desarrollar un segundo tumor. El pronóstico de los TMBE es igual de favorable que el de los TSB. La presencia de focos de carcinoma intraepitelial o de microinvasión del estroma no afecta al pronóstico (55-57). No se han descrito casos de pacientes fallecidas a causa de TMBE, aunque el seguimiento de la mayoría de casos publicados es inferior a 5 años (54,56,57,59-61). No se ha demostrado que el tratamiento quimioterápico sea de utilidad en pacientes con TMBE en estadios avanzados (2,54).
Tumores mucinosos borderline de tipo intestinal
Los TMB de tipo intestinal (TMBI) representan el 85% de los TMB y ocurren en mujeres cuya edad oscila entre los 40 y 70 años (media 52 años) (2). Entre el 80-90% se encuentran en estadio I y sólo el 5% de ellos son bilaterales (2). La bilateralidad, en el caso de un tumor mucinoso, aconseja excluir la posibilidad de metástasis de adenocarcinoma generalmente de origen gastrointestinal o pancreático. Asimismo, los tumores ováricos bilaterales que se acompañan de pseudomixoma peritoneal suelen ser de origen apendicular (62,63).
Rasgos macroscópicos
Los tumores miden por término medio 19 cm de diámetro, suelen ser multiquísticos y contienen moco líquido (40). Los quistes se encuentran revestidos por pólipos y papilas. El examen macroscópico no permite distinguir los tumores mucinosos benignos de los borderline o de los carcinomas.
Rasgos microscópicos
Los TMBI tienen quistes y glándulas revestidos por epitelio mucinoso atípico de tipo gastrointestinal (fig. 14). Los quistes contienen papilas finas que se ramifican. El epitelio de revestimiento muestra células caliciformes y puede tener células argirófilas y de Paneth. Las células epiteliales muestran estratificación de 2 ó 3 hileras, atipia nuclear leve a moderada y un número variable de mitosis. No se observa invasión del estroma. La mayoría de los TMBI también contiene focos de epitelio mucinoso benigno. Puede haber necrosis focal e inflamación aguda.
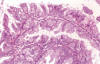
Fig. 14:
Tumor mucinoso borderline de tipo intestinal. Se
observan papilas ramificadas con ejes conectivos muy finos y revestidas por 2-3
hileras de células. La atipia nuclear es leve y no se observa invasión del
estroma.
Los TMBI pueden mostrar focos de proliferación epitelial de 4 o más hileras de células, con arquitectura cribiforme, papilas carentes de estroma y atipia nuclear moderada (grado 2) o severa (grado 3) (fig. 15). No está claro si dichos focos deberían clasificarse como carcinomas no invasivos o como tumores borderline (41). No obstante, varios estudios recientes han demostrado que estos tumores siguen casi siempre un curso clínico benigno (64-68). Por ello, es preferible clasificarlos como TMBI con carcinoma intraepitelial (2,3). Este diagnóstico se basa principalmente en las características citológicas. Aunque no hay acuerdo en cuanto a la cantidad mínima de epitelio con características de malignidad necesaria para establecer dicho diagnóstico, el límite superior se mezcla imperceptiblemente con el carcinoma mucinoso invasivo de crecimiento expansivo y se ha establecido arbitrariamente en torno a los 10 mm2.
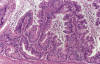
Fig. 15:
Tumor mucinoso borderline con carcinoma
intraepitelial. Arquitectura glandular compleja con atipia nuclear (grado 2) y
mitosis.
Aproximadamente el 10% de los TMBI contienen uno o más focos de microinvasión del estroma (definidos arbitrariamente como no superiores a 10 mm2). Los focos microinvasivos suelen medir <1 o 2 mm de diámetro. Se han descrito cerca de 40 casos (24,58,66-68), que han seguido un curso favorable. Sin embargo, es preciso distinguir el TMB con microinvasión del carcinoma microinvasivo. Mientras que el componente microinvasivo y las glándulas adyacentes del TMB sólo muestran atipia nuclear de bajo grado, las células del carcinoma microinvasivo suelen mostrar núcleos de grado 3. Recientemente se han descrito 4 casos de TMBI con carcinoma intraepitelial –2 de ellos con carcinoma microinvasivo– asociados a mal pronóstico (69).
Tratamiento y pronóstico
Los TMBI en estadio I se tratan igual que los TSB. En las mujeres jóvenes que deseen conservar su capacidad reproductiva puede realizarse una ooforectomía unilateral. Se recomienda el seguimiento prolongado con objeto de excluir el desarrollo de un tumor similar en el ovario contralateral. En el estudio intraoperatorio el patólogo debe tener en cuenta la posibilidad de encontrar carcinoma más tarde tras haber examinado un mayor número de muestras. En las pacientes con tumores ováricos bilaterales o con pseudomixoma peritoneal, debe resecarse el apéndice y debe explorarse la cavidad abdominal con el fin de identificar el origen del tumor. Según el informe anual de la FIGO, los TMBI se encuentran localizados en uno o ambos ovarios (estadio I) en el 82% de los casos, 6% en estadio II, 10% en estadio III y 2% en estadio IV (15). Casi todos los TMBI en estadio II-III se asocian con pseudomixoma peritoneal. Por tanto, cabe preguntarse si tras excluir este grupo de pacientes, en quienes los tumores ováricos son casi siempre secundarios a un tumor apendicular, se justifica el término «borderline», más aún cuando la supervivencia a los 5 años en estas pacientes se acerca al 100% (67). Sin embargo, como se ha dicho antes, el término «borderline» indica que estos tumores representan estadios intermedios de la carcinogénesis y pueden acompañarse de carcinomas, tanto intraepiteliales como invasivos. También es posible que algunos TMBI sean responsables de aquellos raros casos de pseudomixoma peritoneal en los que el apéndice no contiene un tumor mucinoso (66,68). En los TMBI en estadios avanzados (sin pseudomixoma peritoneal) las metástasis se presentan como implantes peritoneales invasivos y el pronóstico es similar al de los carcinomas mucinosos. Es probable que en algunos de estos casos no se detectasen focos invasivos en el tumor ovárico debido a un muestreo insuficiente (53,66,68).
Tumores mucinosos quísticos asociados con pseudomixoma peritoneal
El término clínico «pseudomixoma peritoneal» se utiliza para describir el acúmulo de moco extracelular (ascitis gelatinosa) debido a la ruptura o filtración de un tumor intra-abdominal. El moco puede contener cantidades variables de células epiteliales cuyo grado de atipia posee valor pronóstico. Las pacientes con células epiteliales de aspecto benigno o borderline tienen mucho mejor pronóstico que las que tienen células francamente malignas (carcinomatosis peritoneal) (66,70). No obstante, los tumores benignos y borderline también se asocian a un aumento de la mortalidad (45% de supervivencia a los 10 años) (71) por lo que se ha propuesto su designación como carcinomas mucinosos de bajo grado de malignidad (72). Aunque existe acuerdo general en que la mayor parte de estos tumores se origina en el apéndice, aún se discute si algunos casos podrían originarse en el ovario. En nuestra experiencia, no es infrecuente encontrar un pequeño tumor apendicular tras haber solicitado la resección del apéndice a pesar de su aspecto normal. Aunque los tumores sincrónicos ováricos y apendiculares se habían considerado tradicionalmente como neoplasias primarias independientes, actualmente existe evidencia más que suficiente de que se trata de tumores metastáticos del apéndice al ovario (fig. 16) (53,62,73,74).
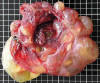
Fig. 16:
Tumor ovárico mucinoso quistico asociado a
pseudomixoma peritoneal y a un tumor mucinoso del apéndice Cortesía del Prof.
Jerónimo Forteza, Santiago.
La evidencia macro y microscópica incluye: a) presentación simultánea de ambos tumores (ovárico y apendicular) en pacientes con pseudomixoma peritoneal; b) semejanza histológica de ambos tumores; c) frecuente bilateralidad de los tumores ováricos (los TMBI suelen ser unilaterales y no se asocian con pseudomixoma peritoneal); d) predominio de afección del ovario derecho en caso de tumores unilaterales; e) afección de la superficie ovárica y/o presencia de moco extracelular en el estroma ovárico (pseudomixoma ovárico) (fig. 17), hallazgo infrecuente en los tumores ováricos primarios; f) presencia de epitelio columnar alto en los tumores ováricos asociados a pseudomixoma peritoneal; y g) los tumores apendiculares muestran siempre los rasgos histológicos característicos de un tumor primario, bien sean adenomas (fig. 18) o adenocarcinomas (53,62,73,74).

Fig. 17:
Tumor ovárico mucinoso asociado a pseudomixoma
peritoneal y a un tumor mucinoso apendicular. Se observan lagos de moco en el
estroma ovárico (pseudomixoma ovárico).

Fig. 18:
Tumor mucinoso de apéndice asociado a
pseudomixoma peritoneal y a tumores ováricos mucinosos bilaterales.
Los resultados de los estudios de genética molecular también apoyan el origen apendicular de estos tumores. Se ha encontrado concordancia de las mutaciones de K-ras en ambos tumores (ovárico y apendicular) en prácticamente cada una de las pacientes investigadas. Ello indica que, probablemente, se trataba del mismo tumor (75,76).
Pronóstico y tratamiento
Las pacientes con pseudomixoma peritoneal que contiene células epiteliales benignas o borderline suelen seguir un curso clínico lento y prolongado. La supervivencia a los 5 y 10 años es de 75% y 68% respectivamente. Por el contrario, cuando las células epiteliales del pseudomixoma peritoneal son claramente malignas (carcinomatosis peritoneal), el curso clínico es más agresivo y aproximadamente el 90% de las pacientes fallece antes de 3 años. Ni la cirugía citorreductiva inicialmente, ni los repetidos «debulking» paliativos, los agentes mucolíticos, la quimioterapia o la radioterapia han logrado modificar el curso lento pero progresivo de la enfermedad (77-79).
TUMORES ENDOMETRIOIDES BORDERLINE
Rasgos clínicos
Los tumores epiteliales endometrioides representan el 2-4% de todos los tumores ováricos (2). Sólo el 2-3% de los tumores ováricos borderline son endometrioides. Estos tumores ocurren sobre todo en mujeres peri o posmenopáusicas de alrededor de 51 años de edad (2). Se asocian a menudo con endometriosis ipsilateral o pélvica. La endometriosis atípica ipsilateral podría participar en el proceso de transformación maligna (82).
Rasgos patológicos
Aún no se han establecido claramente los criterios diagnósticos de los tumores endometrioides borderline. La mayoría son adenofibromas constituidos por numerosas glándulas de aspecto endometrial y quistes rodeados de estroma de tipo ovárico o colágeno-hialino (fig. 19). Según los criterios de la OMS, las glándulas y quistes se encuentran revestidos por células de tipo endometrioide atípicas o con características citológicas de malignidad pero no muestran invasión del estroma.3 En aproximadamente la mitad de los casos se observa metaplasia escamosa, que puede ser florida y queratinizante. Cuando el componente epitelial es carcinoma, se recomienda usar el término de tumor endometrioide borderline con carcinoma intraepitelial y evaluar el grado del mismo (entre 1 y 3). La microinvasión se define arbitrariamente de ≤10 mm2 (2). Los tumores que muestran proliferación glandular confluente (de 5 o más mm de diámetro) e invasión destructiva del estroma que sobrepasa la microinvasión se diagnostican de carcinomas invasivos. Ni el grado de atipia citológica ni la presencia de microinvasión parecen afectar el pronóstico favorable de los tumores endometrioides borderline. El tratamiento conservador mediante salpingo-ooforectomía unilateral es curativo. Sin embargo, el número de casos publicados es escaso y con seguimiento limitado (80).
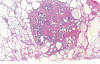
Fig. 19:
Tumor endometrioide borderline (adenofibroma).
Glandulas y quistes de tipo endometrial rodeados de estroma fibroso denso.
Inmunohistoquímica y genética molecular
En los tumores endometrioides borderline las mutaciones del gen de la beta-catenina ocurren precozmente (85). En un estudio reciente de 8 de estos tumores se obtuvo una inmunorreacción nuclear intensa para beta-catenina (tanto en el componente glandular como en el escamoso) y 7 (90%) tumores tenían mutaciones del gen CTNNB1.
TUMORES BORDERLINE DE CÉLULAS CLARAS
Los tumores borderline de células claras representan menos del 1% de los tumores ováricos borderline (2). Los adenofibromas tienen un aspecto macroscópico inespecífico, miden entre 10-12 cm de diámetro (2) y suelen ser unilaterales (15). A veces, las glándulas quísticas son tan numerosas que confieren un aspecto esponjoso a la superficie de corte del tumor (cistoma parvilocular). Los quistes contiene líquido seroso o mucinoso; o bien contienen líquido espeso y achocolatado cuando el tumor se ha originado en un quiste endometriótico. Muestran un epitelio atípico que no invade el estroma (la presencia de uno o más focos de menos de 10 mm2 no cambia el diagnóstico) (fig. 20) (2,3). Se observa atipia nuclear, estratificación celular y mitosis (hasta 3 por 10 campos de gran aumento). Rara vez se observan auténticas papilas. Antes de hacer el diagnóstico de adenofibroma de células claras deben tomarse numerosas muestras con el fin de excluir la presencia de un carcinoma de células claras oculto. Los tumores borderline de células claras ocurren más frecuentemente asociados a carcinoma que en forma pura (2).
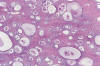
Fig. 20:
Tumor borderline de células claras (adenofibroma)
con microinvasion del estroma. Glándulas quísticas, revestidas por células
aplandas y «hobnail cells» y rodeadas de abundante estroma fibroso.
TUMORES DE BRENNER BORDERLINE
Los tumores de Brenner borderline representan menos del 5% de todos los tumores de Brenner y la mayoría ocurre en mujeres de más de 50 años (2,3). En el momento del diagnóstico, los tumores se localizan en el ovario y son casi siempre unilaterales (2). Derivan directamente del epitelio de superficie del ovario (metaplasia urotelial) o bien de la rete ovarii, que es de origen celómico o mesonéfrico (75). En raros casos se desarrollan en la proximidad de un quiste dermoide, de un estruma ovárico o de un tumor carcinoide, lo que sugiere un posible origen germinal (2). Suelen ser de gran tamaño (entre 16-20 cm de diámetro), quísticos, uniloculares o multiloculares y contienen masas papilomatosas que sobresalen en la luz de los quistes. Rara vez son sólidos (2,3). Los pólipos se parecen a los tumores papilares uroteliales (fig. 21). Por definición, no se observa invasión del estroma. Aunque suele encontrase un componente de tumor de Brenner benigno, puede pasar desapercibido. El índice mitótico es muy variable y a veces hay focos de necrosis. También puede encontrase abundante metaplasia mucinosa.
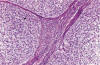
Fig. 21:
Tumor de Brenner borderline. El tumor muestra
células transicionales de bajo grado y es semejante a un carcinoma papilar de
celulas transicionales de vejiga urinaria (grado 1).
Los criterios diagnósticos de los tumores de Brenner borderline son controvertidos. Puesto que no se han publicado casos con extensión extraovárica o que hayan seguido una conducta agresiva, algunos autores han propuesto utilizar el término «proliferativo» en lugar de borderline. Otros, sin embargo, prefieren usar el término de tumores de Brenner borderline con carcinoma intraepitelial cuando estos tumores recuerdan a los carcinomas transicionales del tracto urinario (grado 2 o 3) (2). En caso de atipia severa, deben tomarse numerosas muestras para excluir la presencia de un componente invasivo. Aproximadamente el 75% de los tumores de Brenner borderline expresan uroplaquina III (Uro-III) y trombomodulina pero no reaccionan para la citoqueratina 20 (83,84,86-89). Se han encontrado mutaciones en el codón 12 del oncogén K-ras lo que indica que dichas mutaciones se asocian con el fenotipo mucinoso.
En mujeres jóvenes, los tumores de Brenner borderline se tratan con cirugía conservadora. Aunque no se ha descrito extensión extraovárica en ninguno de los más de 50 casos publicados (2), recientemente hemos visto uno de estos tumores que recidivó en el útero tras la resección incompleta por vía laparoscópica.
BIBLIOGRAFÍA
Prat J. Pathology of the Ovary. Philadelphia: Saunders, 2004: 83-109.
Scully RE, Young RH, Clement PB. Tumors of the ovary, maldeveloped gonads, fallopian tube, and broad ligament. In: Rosai J, Sobin LH eds Atlas of Tumor Pathology 3rd ed., Vol. 23. Washington, DC: Armed Forces Institute of Pathology; 1998.
Lee KR, Tavassoli FA, Prat J, Dietel M, Gersell DJ, Karseladze AI, et al. Tumours of the ovary and peritoneum: Surface epithelial-stromal tumours. In: Tavassoli FA, Devilee P, editores. World Health Organization Classification of Tumours. Pathology and Genetics of Tumours of the Breast and Female Genital Organs. Lyon, France: IARC Press; 2003.
Prat J. Ovarian tumors of borderline malignancy (tumors of low malignant potential): a critical appraisal. Adv Anat Pathol 1999; 6: 247-74.
Bell DA, Weinstock MA, Scully RE. Peritoneal implants of ovarian serous borderline tumors. Histologic features and prognosis. Cancer 1988; 62: 2212-22.
Gershenson DM, Silva EG, Levy L, Burke TW, Wolf JK, Tornos C. Ovarian serous borderline tumors with invasive peritoneal implants. Cancer 1998; 82: 1096-103.
Gershenson DM, Silva EG, Tortolero-Luna G, Levenback C, Morris M, Tornos C. Serous borderline tumors of the ovary with noninvasive peritoneal implants. Cancer 1998; 83: 2157-163.
Gilks CB, Alkushi A, Yue JJ, Lanvin D, Ehlen TG, Miller DM. Advanced-stage serous borderline tumors of the ovary: a clinicopathological study of 49 cases. Int J Gynecol Pathol 2003; 22: 29-36.
Kennedy AW, Hart WR. Ovarian papillary serous tumors of low malignant potential (serous borderline tumors). A long term follow-up study, including patients with microinvasion, lymph node metastasis, and transformation to invasive serous carcinoma. Cancer 1996; 78: 278-86.
Longacre TA, McKenney JK, Tazelaar HD, Kempson RL, Hendrickson MR. Ovarian serous tumors of low malignant potential (borderline tumors). Outcome-based study of 276 patients with long-term (?5-year) follow-up. Am J Surg Pathol 2005; 29: 707-23.
Prat J, de Nictolis M. Serous borderline tumors of the ovary. A long-term follow-up study of 137 cases, including 18 with micropapillary pattern and 20 with microinvasion. Am J Surg Pathol 2002; 26: 1111-28.
Seidman JD, Kurman RJ. Subclassification of serous borderline tumors of the ovary into benign and malignant types. A clinicopathologic study of 65 advanced stage cases. Am J Surg Pathol 1996; 20: 1331-45.
Seidman JD, Kurman RJ. Ovarian serous borderline tumors: a critical review of the literature with emphasis on prognostic factors. Hum Pathol 2000; 31: 539-57.
Koonings PP, Campbell K, Mishell DR Jr, Grimes DA. Relative frequency of primary ovarian neoplasms: a ten year reviews. Obstet Gynecol 1989; 74; 1989. p. 921-6.
Pettersson F. Annual report of the results of treatment in gynecological cancer. Stockholm, International Federation of Gynecology and Obstetrics; 1991.
Segal GH, Hart WR. Ovarian serous tumors of low malignant potential (serous borderline tumors). The relationship of exophytic surface tumor to peritoneal «implants». Am J Surg Pathol 1992; 16: 577-83.
Burks RT, Sherman ME, Kurman RJ. Micropapillary serous carcinoma of the ovary. A distinctive low-grade carcinoma related to serous borderline tumors. Am J Surg Pathol 1996; 20: 1319-30.
Deavers MT, Gershenson DM, Tortolero-Luna G, Malpica A, Lu KH, Silva EG Micropapillary and cribriform patterns in ovarian serous tumors of low malignant potential. A study of 99 advanced stage cases. Am J Surg Pathol 2002; 26: 1129-41.
Eichhorn JH, Bell DA, Young RH, Scully RE. Ovarian serous borderline tumors with micropapillary and cribriform patterns: A study of 40 cases and comparison with 44 cases without these patterns. Am J Surg Pathol 1999; 23: 397-409.
Slomovitz BM, Caputo TA, Gretz HF 3rd, Economos K, Tortoriello DV, Schlosshauer PW, et al. A comparative analysis of 57 serous borderline tumors with and without a noninvasive micropapillary component. Am J Surg Pathol 2002; 26: 592-600.
Katabuchi H, Tashiro H, Cho KR, Kurman RJ, Hedrick Ellenson L. Micropapillary serous carcinoma of the ovary: an immunohistochemical and mutational analysis of p53. Int J Gynecol Pathol 1998; 17: 54-60.
Bell DA, Scully RE Ovarian serous borderline tumors with stromal microinvasion: a report of 21 cases. Hum Pathol 1990; 21: 397-403.
McKenney JK, Balzer BL, Longacre TA. Patterns of stromal invasion in ovarian serous tumors of low malignant potential (borderline tumors): a reevaluation of the concept of stromal microinvasion. Am J Surg Pathol 2006; 30: 1209-21.
Nayar R, Siriaunkgul S, Robbins KM, McGowan L, Ginzan S, Silverberb SG. Microinvasion in low malignant potential tumors of the ovary. Hum Pathol 1996; 27: 521-7.
Tavassoli FA. Serous tumor of low malignant potential with early stromal invasion (serous LMP with microinvasion). Mod Pathol 1988; 1: 407-13.
Bell KA, Smith Sehdev AE, Kurman RJ. Refined diagnostic criteria for implants associated with ovarian atypical proliferative serous tumors (borderline) and micropapillary serous carcinomas. Am J Surg Pathol 2001; 25: 419-32.
De Nictolis M, Montironi R, Tommasoni S, Carinelli S, Ojea B, Matías-Guiu X, et al. Serous borderline tumors of the ovary: a clinicopathologic, immunohistochemical and quantitative study of 44 cases. Cancer 1992; 70: 152-60.
McCaughey WTE, Kirk ME, Lester W, Dardick I. Peritoneal epithelial lesions associated with proliferative serous tumors of ovary. Histopathology 1984; 8: 195-208.
Russell P. Borderline epithelial tumours of the ovary: a conceptual dilemma. Clin Obstet Gynecol 1984; 11: 259-77.
Caduff RF, Svoboda-Newman SM, Ferguson AW, Johnston CM, Frank TS. Comparison of mutations of Ki-ras and p53 immunoreactivity in borderline and malignant epithelial ovarian tumors. Am J Surg Pathol 1999; 23: 323-8.
Singer G, Kurman RJ, Chang H-W, Cho SKR, Shih I-M. Diverse tumorigenic pathways in ovarian serous carcinoma. Am J Pathol 2002; 160: 1223-8.
Sieben NLG, Oosting J, Flanagan AM, Prat J, Roemen GM, Kolkman-Uljee SM, et al. Differential gene expression in ovarian tumors reveals Dusp-4 and serpina-5 as key regulators for benign behavior of serous borderline tumors. J Clin Oncol 2005; 23: 7257-64.
Bonome T, Lee JY, Park DC, Radonovich M, Pise-Masison C, Brady J, et al. Expression profiling of serous low malignant potential, low-grade, and high-grade tumors of the ovary. Cancer Res 2005; 65: 10602-12.
Sieben NLG, Roemen GMJM, Oosting J, Fleuren GJ, Engeland Mv, Prat J. Clonal analysis favours a monoclonal origin for serous borderline tumours with peritoneal implants. J Pathol 2006; 210: 405-11.
Parker RL, Clement PB, Chercover DJ, Sornarajah T, Gilks CB. Early recurrence of ovarian serous borderline tumor as high-grade carcinoma: A report of two cases. Int J Gynecol Pathol 2004; 23: 265-72.
Leake JF, Rader JS, Woodruff JD, Rosenshein NB. Retroperitoneal lymphatic involvement with epithelial ovarian tumors of low malignant potential. Gynecol Oncol 1991; 42: 124-30.
McKenney JK, Balzer BL, Longacre TA. Lymph node involvement in ovarian serous tumors of low malignant potential (borderline tumors): Pathology, prognosis, and proposed classification. Am J Surg Pathol 2006; 30: 614-24.
Tan LK, Flynn SD, Carcangiu ML. Ovarian serous borderline tumors with lymph node involvement. Clinicopathologic and DNA content study of seven cases and review of the literature. Am J Surg Pathol 1994; 18: 904-12.
Bell DA, Scully RE. Serous borderline tumors of the peritoneum. Am J Surg Pathol 1990; 14: 230-9.
Biscotti CV, Hart WR. Peritoneal serous papillomatosis of low malignant potential (serous borderline tumors of the peritoneum). A clinicopathologic study of 17 cases. Am J Surg Pathol 1992; 16: 467-75.
Barnhill DR, Kurman RJ, Brady MF, Omura GA, Yordan E, Given FT, et al. Preliminary analysis of the behavior of stage I ovarian serous tumors of low malignant potential: a Gynecologic Oncology Group study. J Clin Oncol 1995; 13: 2752-6.
Lim-Tan SK, Cajigas HE, Scully RE. Ovarian cystectomy for serous borderline tumors: A follow-up study of 35 cases. Obstet Gynecol 1988; 72: 775-81.
Lin PS, Gershenson DM, Bevers MW, Lucas KR, Burke TW, Silva EG. The current status of surgical staging of ovarian serous borderline tumors. Cancer 1999; 85: 905-11.
Papadimitriou DS, Martin-Hirsch P, Kitchener HC, Lolis DE, Dalkalitsis N, Paraskevaidis E. Recurrent borderline tumors after conservative treatment management in women wishing to retain their fertility. Eur J Gynecol Oncol 1999; 20: 94-7.
Gershenson DM. Contemporary treatment of borderline ovarian tumors. Cancer Invest 1999; 17: 206-10.
Bristow RE, Gossett DR, Shook DR, Zahurak ML, Tomacruz RS, Armstrong DK, et al. Recurrent micropapillary serous ovarian carcinoma: the role of secondary cytoreductive surgery. Cancer 2002; 95: 791-800.
Heintz AP, Odicino F, Maisonneuve P, Beller U, Benedet JL, Creasman WT, et al. Carcinoma of the ovary. Int J Gynecol Obstet 2003; 83S: 133-66.
Zuna RE, Behrens A. Peritoneal washing cytology in gynecologic cancers. J Natl Cancer Inst 1996; 88: 980-87.
Cuatrecasas M, Villanueva A, Matias-Guiu X, Prat J. K-ras mutations in mucinous ovarian tumors: a clinicopathologic and molecular study of 95 cases. Cancer 1997; 79: 1581-6.
Ichikawa Y, Nishida M, Suzuki H, Yoshida S, Tsunoda H, Kubo T, et al. Mutation of K-ras protooncogene is associated with histological subtypes in human mucinous ovarian tumors. Cancer Res 1994; 54: 33-5.
Mandai M, Konishi I, Kuroda H, Komatsu T, Yamamoto S, Nanbu K, et al. Heterogeneous distribution of K-ras-mutated epithelia in mucinous ovarian tumors with special reference to histopathology. Hum Pathol 1998; 28: 34-40.
Mok SC, Bell DA, Knapp RC, Fishbaugh PM, Welch WR, Muto MG, et al. Mutation of K-ras protooncogene in human ovarian epithelial tumors of borderline malignancy. Cancer Research 1993; 53: 1489-92.
Hart WR. Mucinous tumors of the ovary: A review. Int J Gynecol Pathol 2005; 24: 4-25.
Rutgers JL, Scully RE. Ovarian müllerian mucinous papillary cystadenomas of borderline malignancy. A clinicopathologic analysis. Cancer 1988; 61: 340-8.
Dubé V, Roy M, Plante M, Renaud MC, Tetu B. Mucinous ovarian tumors of Mullerian-type: an analysis of 17 cases including borderline tumors and intraepithelial, microinvasive, and invasive carcinomas. Int J Gynecol Pathol 2005; 24: 138-46.
Rodriguez IM, Irving JA, Prat J. Endocervical-like mucinous tumors of the ovary. A clinicopathologic analysis of 31 cases. Am J Surg Pathol 2004; 28: 1311-8.
Shappell HW, Riopel MA, Smith Sehdev AE, Ronnett BM, Kurman RJ. Diagnostic criteria and behavior of ovarian seromucinous (endocervical-type mucinous and mixed cell-type) tumors: Atypical proliferative (borderline) tumors, intraepithelial, microinvasive, and invasive carcinomas. Am J Surg Pathol 2002; 26: 1529-41.
Khunamornpong S, Russell P, Dalrymple JC. Proliferating (LMP) mucinous tumors of the ovaries with microinvasion: morphologic assessment of 13 cases. Int J Gynecol Pathol 1999; 18: 238-46.
Guerrieri C, Hogberg T, Wingren S, Fristedt S, Simonsen E, Boeryd B. Mucinous borderline and malignant tumors of the ovary. A clinicopathologic and DNA ploidy study of 92 cases. Cancer 1994; 74: 2329-40.
Nomura K, Aizawa S. Clinicopathologic and mucin histochemical analyses of 90 cases of ovarian mucinous borderline tumors of intestinal and mullerian types. Pathol Int 1996; 46: 575-80.
Siriaunkgul S, Robbins KM, McGowan L, Silverberg SG. Ovarian mucinous tumors of low malignant potential: a clinicopathologic study of 54 tumors of intestinal and müllerian type. Int J Gynecol Pathol 1995; 14: 198-208.
Young RH, Gilks CB, Scully RE. Mucinous tumors of the appendix associated with mucinous tumors of the ovary and pseudomyxoma peritonei. A clinicopathological analysis of 22 cases supporting an origin in the appendix. Am J Surg Pathol 1991; 15: 415-29.
Young RH, Hart WR. Metastases from carcinomas of the pancreas simulating primary mucinous tumors of the ovary: a report of seven cases. Am J Surg Pathol 1989; 13: 748-56.
De Nictolis M, Montironi R, Tommasoni S, Valli M, Pisani E, Fabris G, et al. Benign, borderline and well-differentiated malignant intestinal mucinous tumors of the ovary: a clinicopathologic, histochemical, immunohistochemical and nuclear quantitative study of 57 cases. Int J Gynecol Pathol 1994; 13: 10-21.
Hoerl HD, Hart WR. Primary ovarian mucinous cystadenocarcinomas. A clinicopathologic study of 49 cases with long term follow-up. Am J Surg Pathol 1998; 22: 1449-62.
Lee KR, Scully RE. Mucinous tumors of the ovary. A clinicopathologic study of 196 borderline tumors (of intestinal type) and carcinomas, including an evaluation of 11 cases with «pseudomyxoma peritonei». Am J Surg Pathol 2000; 24: 1447-64.
Riopel MA, Ronnett BM, Kurman RJ. Evaluation of diagnostic criteria and behavior of ovarian intestinal-type mucinous tumors. Atypical proliferative (borderline) tumors and intraepithelial, microinvasive, invasive and metastatic carcinomas. Am J Surg Pathol 1999; 23: 617-35.
Rodriguez IM, Prat J. Mucinous tumors of the ovary. A clinicopathologic analysis of 75 borderline tumors (of intestinal type) and carcinomas. Am J Surg Pathol 2002; 26: 139-52.
Ludwick C, Gilks CB, Miller D, Yaziji H, Clement PB. Aggressive behavior of stage I ovarian mucinous tumors lacking extensive infiltrative invasion: a report of four cases and review of the literature. Int J Gynecol Pathol 2005; 24: 205-17.
Ronnett BM, Yan H, Kurman RJ, Shmookler BM, Wu L, Sugarbaker PH, et al. Patients with pseudomyxoma peritonei associated with disseminated peritoneal adenomucinosis have a significantly more favorable prognosis than patients with peritoneal mucinous carcinomatosis. Cancer 2001; 92: 85-91.
Misdraji J, Yantiss RK, Graeme-Cook FM, Balis UJ, Young RH. Appendiceal mucinous neoplasms. A clinicopathologic analysis of 107 cases. Am J Surg Pathol 2003; 27: 1089-103.
Bradley RF, Stewart JH, Russell GB, Levine EA, Geisinger KR. Pseudomyxoma peritonei of appendiceal origin: a clinicopathologic analysis of 101 patients uniformly treated at a single institution, with literature review. Am J Surg Pathol 2006; 30: 551-9.
Prayson RA, Hart WR, Petras RE. Pseudomyxoma peritonei. A clinicopathologic study of 19 cases with emphasis on site of origin and nature of associated ovarian tumors. Am J Surg Pathol 1994; 18: 591-603.
Ronnett BM, Kurman RJ Zahn CM, Shmookler BM, Jablonski KA, Kass ME, et al. Pseudomyxoma peritonei in women: a clinicopathologic analysis of 30 cases with emphasis on site of origin, prognosis, and relationship to ovarian mucinous tumors of low malignant potential. Hum Pathol 1995; 26: 509-24.
Cuatrecasas M, Matias-Guiu X, Prat J. Synchronous mucinous tumors of the appendix and the ovary associated with pseudomyxoma peritonei: A clinicopathologic study of six cases with comparative analysis of c-Ki-ras mutations. Am J Surg Pathol 1996; 20: 739-46.
Szych C, Staebler A, Connolly DC, Wu R, Cho KR, Ronnett BM. Molecular genetic evidence supporting the clonality and appendiceal origin of Pseudomyxoma peritonei in women. Am J Pathol 1999; 154: 1849-55.
Gough DB, Donohue JH, Schutt AJ, Gonchoroff N, Goellner JR, Wilson TO, et al. Pseudomyxoma peritonei. Long-term patient survival with an aggressive regional approach. Ann Surg 1994; 219: 112-9.
Look KY, Stehman FB, Moore DH, Sutton GP. Intraperitoneal 5-fluorouracil for pseudomyxoma peritonei. Int J Gynecol Cancer 1995; 5: 361-5.
Wertheim I, Fleischhacker D, McLachlin CM, Rice LW, Berkowitz RS, Goff BA, et al. Pseudomyxoma peritonei: a review of 23 cases. Obstetrics and Gynecology 1994; 84: 17-21.
Bell KA, Kurman RJ. A clinicopathologic analysis of atypical proliferative (borderline) tumors and well-differentiated endometrioid adenocarcinomas of the ovary. Am J Surg Pathol 2000; 24: 1465-79.
Cuatrecasas, M, Erill, N, Musulen, E, Costa, I, Matias-Guiu, X, Prat, J. K-ras mutations in nonmucinous ovarian epithelial tumors: A molecular analysis and clinicopathological study of 144 patients. Cancer 1998; 82: 1088-95.
Fukunaga M, Nomura K, Ishikawa E, Ushigome S. Ovarian atypical endometriosis: its close association with malignant epithelial tumors. Histopathology 1997; 30: 249-55.
Logani S, Oliva E, Amin MB, Folpe AL, Cohen C, Young RH. Immunoprofile of ovarian tumors with putative transitional cell (urothelial) differentiation using novel urothelial markers: histogenetic and diagnostic implications. Am J Surg Pathol 2003; 27: 1434-41.
Ogawa K, Johansson SL, Cohen SM. Immunohistochemical analysis of uroplakins, urothelial specific proteins, in ovarian Brenner tumors, normal tissues, and benign and neoplastic lesions of the female genital tract. Am J Pathol 1999; 155: 1047-50.
Oliva E, Sarrió D, Brachtel EF, Sánchez-Estévez C, Soslow RA, Moreno-Bueno G, et al. High frequency of beta-catenin mutations in borderline endometrioid tumors of the ovary. J Pathol 2006; 208: 708-13.
Ordonez NG. Transitional cell carcinomas of the ovary and bladder are immunophenotypically different. Histopathology 2000; 36: 433-8.
Ordonez NG, Mackay B. Brenner tumor of the ovary: a comparative immunohistochemical and ultrastructural study with transitional cell carcinoma of the bladder. Ultrastruct Pathol 2000; 24: 157-67.
Riedel I, Czernobilsky B, Lifschitz-Mercer B, Roth LM, Wu XR, Sun TT, et al. Brenner tumors but not transitional cell carcinomas of the ovary show urothelial differentiation: immunohistochemical staining of urothelial markers, including cytokeratins and uroplakins. Virchows Arch 2001; 438: 181-91.
Soslow RA, Rouse RV, Hendrickson MR, Silva EG, Longacre TA. Transitional cell neoplasms of the ovary and urinary bladder: a comparative immunohistochemical analysis. Int J Gynecol Pathol 1996; 15: 257-65.