Vol. 40, n.º 3, 2007
REVISTA
ESPAÑOLA DE
Vol. 40, n.º 3, 2007 |
|
Homenaje
al Dr. Francisco José Martínez Tello |
REVISIONES
Francisco Colina, Carolina Ibarrola, Guadalupe López-Alonso, Andrés Pérez-Barrios
Departamento de Anatomía Patológica. Hospital
Universitario 12 de Octubre, Madrid. Ctra. de Andalucía, km 5,4. 28041 Madrid
fcolina.hdoc@salud.madrid.org
RESUMEN
Este protocolo-guía para el diagnóstico histopatológico del carcinoma hepatocelular es un documento de trabajo de la Subcomisión de Tumores Digestivos del Hospital 12 de Octubre que pretende consensuar un acuerdo intrahospitalario para la utilización de las nomenclaturas acreditadas en la literatura de forma que sean homogéneas y uniformes para evitar malentendidos que lleven a conductas diferentes en el manejo de pacientes con el mismo tipo de lesión. Asimismo, intenta informar a clínicos y radiólogos de lo que pueden esperar del diagnóstico citohistológico de los posibles especimenes de un paciente con diagnóstico sospechado o confirmado de carcinoma hepatocelular.
Palabras Clave: Hepatocarcinoma, diagnóstico histológico, protocolo clínico, comisión de tumores, algoritmo.
SUMMARY
This protocol for the histopathological diagnosis of hepatocellular carcinoma is an internal use document of the Subcommitte of Digestive Tumours of the Hospital 12 de Octubre that intends a consensus in the use of accredited nomenclatures to obtain uniform and homogeneous interpretations aiming analogous and correct managements in patients with similar types of lesions. The protocol also aims to give useful information to clinicians and radiologists about what can they expect of a cyto-histological diagnosis in the specimens of a patient with suspected or confirmed diagnosis of hepatocellular carcinoma.
Key words: Hepatocellular carcinoma, histological diagnosis, clinical protocol, committee of tumours, algorithm.
INTRODUCCIÓN
La Subcomisión de Tumores Digestivos del Hospital 12 de Octubre de Madrid está integrada por facultativos de todas las especialidades implicadas en el diagnóstico, tratamiento y seguimiento de las citadas neoplasias. Realiza dos tipos de reuniones periódicas, una semanal con objetivo asistencial donde se toman decisiones respecto de pacientes concretos y otra quincenal en la que se discuten actuaciones y se elaboran protocolos multidisciplinarios para que la asistencia sea uniforme y adaptada a los últimos conocimientos y conductas terapéuticas. Los protocolos se realizan para los pacientes con tumores más prevalentes del aparato digestivo. En el quinquenio 1999-2003 se atendieron en nuestro hospital 434 cánceres hepáticos (hombre/mujer: 2,4). De ellos 312 (71,9%) fueron pacientes atendidos íntegramente en el Hospital 12 de Octubre y 87% eran cirróticos. En el resto de cánceres hepáticos actuamos como apoyo bien sólo en el tratamiento o sólo en el diagnóstico (incluidas las consultas al Departamento de Anatomía Patológica). El Registro Hospitalario de Tumores nos comunica que el cáncer hepático representa el 2,6% de todos los cánceres y el 11,9% de los 3.657 cánceres digestivos registrados en esos 5 años. Es el tercero en incidencia entre los tumores digestivos, después del cáncer colorrectal y del cáncer gástrico. La supervivencia a los 5 años del cáncer hepático es del 22,6% en hombres y del 25,9% en mujeres. El Centro Nacional de Epidemiología del Ministerio de Sanidad refiere una supervivencia del 10% y 12% respectivamente para esta topografía neoplásica. Nuestra mejor supervivencia es debida, entre otros posibles factores, al mayor número de casos diagnosticados en un estadio precoz, especialmente al ser descubiertos al estudiar los hígados nativos de pacientes trasplantados.
Este protocolo histopatológico es parte del protocolo hospitalario general y por ello intenta ser útil tanto al patólogo como al resto del personal facultativo implicado en la asistencia de pacientes con posible carcinoma hepatocelular (CHC). Pretende ser una herramienta útil para obtener la información sistematizada que los clínicos y radiólogos pueden esperar del estudio citohistológico de los posibles especímenes de un paciente con diagnóstico sospechado o confirmado de CHC que son remitidos al laboratorio de Anatomía Patológica. Para el patólogo, la adhesión a un protocolo no garantiza el éxito del diagnóstico pero es una herramienta interpuesta entre sus conocimientos de morfología y la emisión de información clínicamente útil (1). Aporta los métodos para obtener esa información con el material disponible. Basado en las circunstancias particulares de un paciente o de un espécimen, el patólogo podría desviarse del protocolo hospitalario pero se aconseja hacer constar en la documentación del paciente la razón del no seguimiento del mismo.
Otro objetivo de este protocolo es consensuar un acuerdo intrahospitalario en la utilización de las posibles nomenclaturas acreditadas en la literatura de forma que sean homogéneas y uniformes para evitar malentendidos que lleven a conductas de manejo distintas para la misma lesión en distintos pacientes. A este respecto es de interés señalar el creciente número de casos que son diagnosticados en estadios precoces y esta revisión del protocolo intrahospitalario previo (del año 2001) (2) pone mayor atención en el manejo y en el uso de nomenclaturas de estas lesiones malignas iniciales (carcinoma hepatocelular pequeño o precoz) y de las lesiones hepatocelulares premalignas (displasia, nódulo displásico).
En las peticiones de estudio citohistológico que acompañan a los especímenes remitidos al laboratorio de Anatomía Patológica debe constar una información necesaria para la correcta correlación anatomoclínica que concluirá la labor de obtener información morfológica fiable:
a) Datos clínicos relevantes (cirrosis, no cirrosis, desconocido respecto de cirrosis).
b) Diagnóstico clínico y de imagen.
c) Localización intrahepática y tamaño de la LOE.
d) Pruebas de función hepática, tasa de alfa-fetoproteína.
La información a expresar en un informe anatomopatológico de CHC debe incluir: a) el diagnóstico de CHC o de las lesiones hepatocelulares relacionadas, b) una serie de ítems que permitan estadificar las piezas de resección y c) la codificación SNOMED que permita el recuento de casos para determinar la incidencia observada y la recuperación de información por paciente y por grupos de pacientes.
Una relación completa de informaciones suministradas por el conjunto de sus estudios citohistológicos en cada uno de estos pacientes incluiría (1):
Diagnósticos anatomopatológicos previos del paciente (historia morfológica).
Descripción del hígado no tumoral (peso, tamaño).
Descripción de tumor/es (número, localización, tamaño, contorno, características del tejido).
Diagnostico anatomopatológico definitivo de la neoplasia.
Distancia a bordes quirúrgicos.
Descripción del parénquima no tumoral (¿hepatopatía?).
Tipo tumoral (si no es CHC convencional).
Grado histológico.
Extensión de la invasión tumoral (vascular, ganglionar, otros).
Otros nódulos no malignos.
Bordes quirúrgicos infiltrados, no infiltrados.
Trombosis portal.
Codificaciones SNOMED (literal de órgano, topografías, morfologías).
TNM patológico.
SELECCIÓN DE DEFINICIONES Y CRITERIOS DIAGNÓSTICOS DE LAS LESIONES RELACIONADAS CON EL DIAGNÓSTICO DE CHC
La nomenclatura elegida entre las posibles acreditadas por la literatura (ej.: displasia severa, de alto grado, carcinoma «in situ») debe ser homogénea y uniformemente utilizada intrahospitalariamente para evitar malentendidos que lleven a conductas de manejo distintas.
Adenoma hepatocelular (AHC): neoplasia benigna compuesta de hepatocitos que se presenta en un hígado que es histológicamente normal o casi normal. Los hepatocitos son uniformes con normal relación nucleocitoplásmica (3).
Adenomatosis hepática: entidad definida por la presencia de más de 10 adenomas hepatocelulares, pero frecuentemente más de 20, situados en un parénquima normal. Ocasionalmente alguno de los nódulos de una adenomatosis hepática es una hiperplasia nodular focal (4,5).
Carcinoma hepatocelular (CHC) - hepatocarcinoma: neoplasia maligna compuesta por células con diferenciación hepatocelular (3).
Carcinoma hepatocelular (CHC) pequeño (small) (6) o precoz (early) (7,8): estos términos se refieren a la neoplasia maligna de células con buena diferenciación hepatocitaria que mide menos de 2 cm de diámetro (3,9,10). El término muy precoz (very early) se refiere a aquellos menores de 1 cm de diámetro (11). Histológicamente los tumores pequeños y precoces muestran características morfológicas (densidad celular aumentada, trabeculación doble o triple, acinos, eosinofilia o basofilia aumentadas) de muy buena diferenciación indicativas de su estadio inicial. Se encuentran bien en las ecografías realizadas durante estudios de cribado en enfermos con hepatopatía crónica y diagnosticados por microbiopsia o PAAF o bien al ser estudiados en las piezas de hepatectomía. El término «in situ», empleado por autores japoneses (12) es confuso para un tejido como el hepático cuyos hepatocitos normales no residen sobre una membrana basal. Ante esta ausencia anatómica de membrana basal alternativamente proponen llamar «in situ» a aquellas proliferaciones hepatocitarias malignas de muy pequeño tamaño que no muestran destrucción de la trama reticulínica preexistente. Este dato microscópico es muy subjetivo y muy dependiente de la calidad de la tinción histológica (impregnaciones argénticas). Estas lesiones en Occidente posiblemente son clasificadas como nódulos displásicos de alto grado (12).
Carcinoma hepatocelular. Grados: Se utiliza la gradación de la OMS (13) equivalente a la de Edmonson y Steiner (14):
Bien diferenciado: el grado I de Edmonson es el observado en el CHC pequeño o precoz.
Moderadamente diferenciado.
Pobremente diferenciado.
Indiferenciado.
Carcinoma hepatocelular multifocal (multicéntrico): para considerar los nódulos de CHC de carácter multicéntrico han de cumplir alguno de los siguientes 3 criterios: 1) múltiples nódulos de CHC pequeño o CHC convencional coincidente con nódulos de CHC pequeño, 2) áreas de CHC bien diferenciado en las periferias de los varios nódulos neoplásicos presentes o 3) nódulos de CHC de diferentes histologías (13). La situación mas frecuente es cuando existe más de un nódulo de carcinoma hepatocelular, pequeño o precoz o bien diferenciado en el mismo hígado. La multicentricidad puede ser sincrónica o metacrónica y se asocia con mayor tasa de recidiva.
Carcinoma hepatocelular. Subtipos:
Subtipos macroscópicos:
Nodular: único o múltiples nódulos bien delimitados.
Masivo: tumor grande, de limites irregulares que ocupa casi completamente uno de los lóbulos hepáticos.
Difuso: nódulos tumorales pequeños difusamente extendidos por un lóbulo o por todo el hígado. Su gran extensión y su carácter micronodular bastante regular pueden infradiagnosticarlo como cirrosis especialmente en US.
Pedunculado: la mayor parte del tumor crece extrahepático con variable definición de un real pedículo. Infrecuente.
Subtipos anatomoclínicos: Además del nominado como pequeño o precoz, para los CHC avanzados se reconocen algunos tipos microscópicos con características clínicas, epidemiológicas o pronósticas peculiares y diferentes de las del CHC convencional o clásico (fig. 1):
Fibrolamelar (pacientes jóvenes, no asociado a cirrosis y relativo mejor pronóstico, diagnóstico diferencial macroscópico con hiperplasia nodular focal) (15).
Icterógeno (con invasión de grandes ductos biliares) (16).
Hepatocolangiocarcinoma (es suficiente la demostración inmunohistoquímica de canalículos positivos con pCEA combinada con positividad de Hep Par para asegurar la presencia de componente hepatocitario neoplásico y la demostración de mucina neutra con PAS-diastasa para la de componente colangiocarcinomatoso) (17,18,19).
Esclerosante o escirro (frecuentemente asociado a hipercalcemia, puede estar en relación con tratamiento quimio o radioterápico previo, diagnostico diferencial macroscópico con colangiocarcinoma) (20).
CHC con infiltración linfocitaria (mejor pronóstico) (21).
Sarcomatoso (células tumorales fusiformes y anaplásicas, diagnóstico diferencial con sarcomas, puede estar en relación con tratamiento quimio o radioterápico previo) (22).
De células claras (células «acuosas» con abundante glucógeno y microesteatosis, menor proporción de predominio masculino, mejor pronóstico) (23).
Indiferenciado (peor pronóstico) (13).
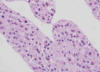
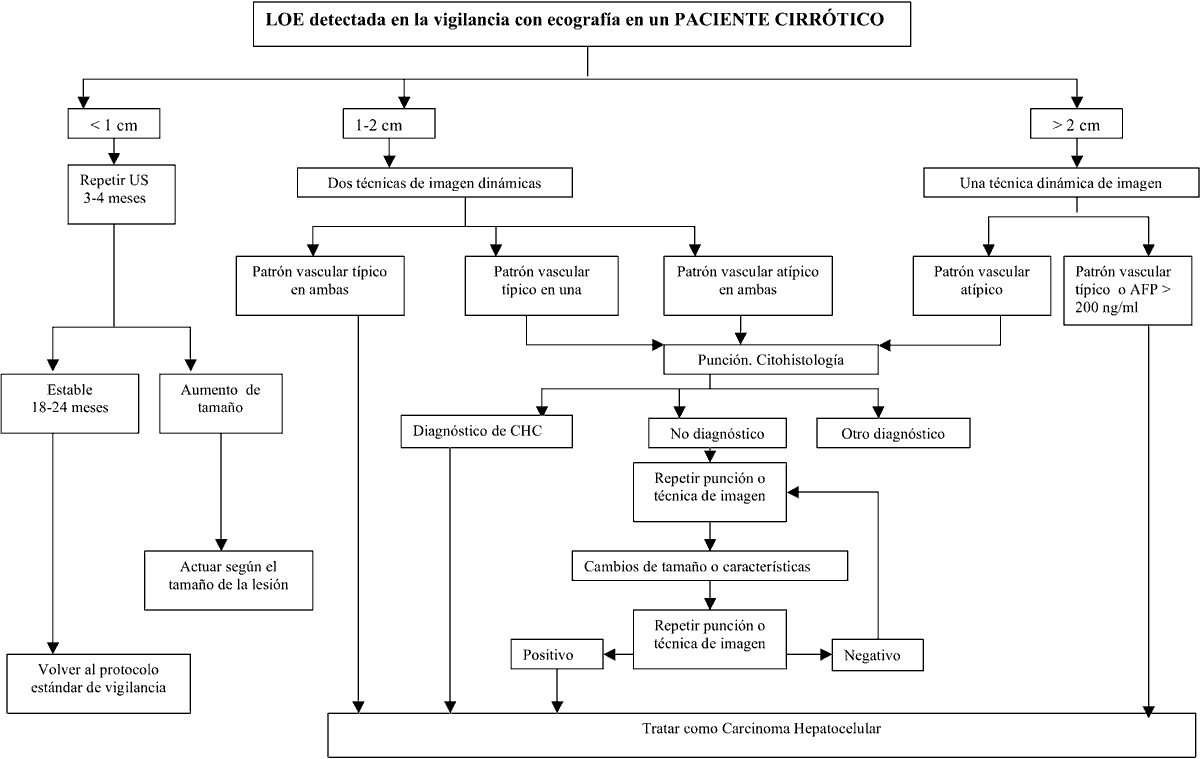
Fig. 1.
Carcinoma hepatocelular convencional bien diferenciado. Trabéculas
multicelulares con atipia nuclear y endotelización.
Subtipos microscópicos: son de interés para el reconocimiento histológico (no utilizar como «tipos», en el diagnóstico anatomopatológico final):
Por su arquitectura pueden ser: trabecular, acinar y sólido (compacto).
Por su citología: hepatocito-similar (clásico o convencional), células pleomórficas, cambio graso, con glóbulos intracitoplásmicos (24), con cuerpos pálidos (pale bodies), con hepatocitos esmerilados y los subtipos microscópicos con interés clinicopatológico arriba citados (indiferenciado, sarcomatoso, esclerosante, con infiltración linfocitaria y de células claras).
Cirrosis: proceso difuso caracterizado por fibrosis y por la transformación de la arquitectura hepática normal en nódulos estructuralmente anormales (25).
Displasia hepatocelular: subpoblación de células hepatocitarias que muestra características histológicas de crecimiento anormal causado por una presumible alteración genética. Es considerada una lesión precancerosa. Las características histológicas son: variaciones citoplásmicas o nucleares y cúmulo topográfico de tales variaciones que permitan reconocer subpoblaciones celulares (8) y monoclonalidad . Por monoclonalidad se entiende que toda o parte de la población de sus hepatocitos presenta rasgos (fenotipo) distintos de la población fuera del foco o nódulo. Si el cúmulo de células displásicas es menor de 1 mm y no es expansivo se denomina «foco displásico» (8) y si es mayor y nodular debe denominarse «nódulo displásico» (26). Se ha recomendado remplazar el término «displasia» por cambio de células grandes, cambio de células pequeñas y cambio de células claras dado que posiblemente no en todos estos tipos de displasia existe alteración genética celular premaligna. Especialmente el cambio de células grandes puede tratarse de poliploídia en una hipermadurez celular.
Displasia Hepatocelular. Tipos:
De células grandes (displasia de Anthony) (27,28): hepatocitos muy grandes (2-3 veces) en cúmulo topográfico, con núcleos irregulares, grandes e hipercromáticos, con nucleolo prominente y ocasional multinucleación, pero sin un aumento de la relación nucleocitoplasmática. Hay autores que no la consideran un cambio premaligno (29,30).
De células pequeñas (15): hepatocitos pequeños en cúmulo topográfico celularmente denso, con poco citoplasma, relación citoplasmática aumentada, núcleo hipercromático de leve pleomorfismo. Acuerdo en la literatura sobre su real carácter premaligno.
De células claras (glucogenización focal): cúmulos o focos de hepatocitos claros similares a los encontrados en la hepatocarcinogénesis experimental (31). Permanece una controversia sobre su significado y si debe considerarse un cambio displásico.
Esteatosis focal: suele tratarse de un área tisular en forma de cuña subcapsular con bordes geográficos pero también puede ser uno o varios focos discretos intrahepáticos. Microscópicamente el tejido hepático conserva su arquitectura, se observan tractos portales y venas centrales pero los hepatocitos son esteatósicos con macrovacuolas y no muestran atipias. Radiográficamente simulan metástasis e histológica o citológicamente pueden sugerir que la muestra no es representativa más que de un hígado esteatósico pero no de la lesión. Es recomendable examinar con atención los núcleos y buscar atipias para excluir adenoma o carcinoma hepatocelulares con cambio graso.
Hepatoblastoma: tumor infantil maligno con dos variantes, tipo epitelial puro que debe incluir células hepáticas maduras (fetales) y embrionarias y tipo mixto epitelio-mesenquimal que junto con epitelio hepatocelular o de otros tipos muestra elementos mesenquimales de variada diferenciación (osteoide, músculo, neuroepitelio) (24). Puede ocurrir en adultos (32). Esta malignidad no es objetivo de este protocolo.
Hiperplasia adenomatosa e hiperplasia adenomatosa atípica: sinónimos de nódulos displásicos de bajo y alto grado respectivamente. Empleados por la literatura japonesa.
Hiperplasia nodular focal (HNF): un nódulo compuesto de hepatocitos benignos que se presenta en un hígado que es histológicamente normal o casi normal. La lesión es perfundida por grandes arterias anormales acompañadas de un estroma fibroso abundante central (cicatriz estrellada) que contiene ductos biliares. El tipo sólido es el más frecuente y el tipo telangiectático simula macroscópicamente hemangioma o peliosis (3).
Hiperplasia nodular focal múltiple: es un síndrome para nominar la suma de al menos dos hiperplasias nodulares focales y de una de las siguientes lesiones: hemangioma hepático, defectos estructurales arteriales («displasia» arterial»), malformaciones vasculares del SNC, meningioma y astrocitoma (3,33).
Hiperplasia nodular regenerativa difusa: transformación micronodular difusa del parénquima hepático en la que los nódulos regenerativos no están circundados por septos fibrosos (34). No es una lesión tumoral sino adaptativa.
Lesión Borderline: sinónimo de nódulo displásico de alto grado (7,8).
Lesión ocupante de espacio (LOE): nominación para nódulo o nódulos situados en el parénquima hepático y visualizados por alguna técnica de imagen (ecografía, tomografía computarizada, resonancia magnética, arteriografía, etc.) antes de su tipificación histológica. Su síndrome bioquímico suele ser una colestasis disociada.
Macronódulo: nódulo macrorregenerativo o multiacinar (con más de un tracto portal) situado en un hígado cirrótico (o en hígado con enfermedad severa de venas portales, venas hepáticas o sinusoides) que es claramente más grande que la mayoría de los nódulos cirróticos circundantes, generalmente de al menos 0,5 cm de diámetro pero puede ser hasta de 5 cm o más. El color y la textura son generalmente similares a los del hígado circundante. Histológicamente sus hepatocitos no muestran atipia (3), ni rasgos de monoclonalidad. Se admite que algunos pueden mostrar cambio de células grandes (displasia de Anthony) (35).
Nódulo Displásico (sinónimo de lesión borderline) (3,6,8,35,36): lesión nodular de al menos 1 mm de diámetro con hepatocitos displásicos. Este término debe ser utilizado si hay características de proceso neoplásico pero no son suficientes para completar los criterios de malignidad. Macroscópicamente son nódulos hepatocelulares distintos (por su color, textura y/o tamaño) del parénquima cirrótico circundante. Microscópicamente sus hepatocitos muestran monoclonalidad expresada por rasgos (fenotipo) morfológicos distintos de los de la población celular de fuera del nódulo (fig. 2). De acuerdo con su grado de displasia se clasifican en bajo o alto grado (anexo 1).
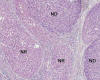
Fig. 2.
Nódulos displásicos (ND) con mayor densidad celular que en los nódulos
regenerativos (NR).
Nódulo Displásico de Bajo Grado (3,8,35) (sinónimo de Hiperplasia Adenomatosa) (8,26): lesión nodular (hipovascular en angiografía y TAC) que microscópicamente muestra densidad celular moderadamente aumentada respecto de los nódulos regenerativos circundantes, con rasgos celulares distintos de la población celular de fuera del nódulo, manifestados por intensidad de tinción basófila o eosinófila aumentada y ya suele haber capilarización parcial de los sinusoides, expresada por positividad CD34 de sus endotelios. Los hepatocitos se disponen en trabéculas de grosor de una o más células y muestran mínima atipia con leve aumento de la relación núcleo-citoplasmática (fig. 3). Separar macronódulo de nódulo displásico de bajo grado es problemático.
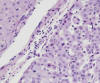
Fig. 3.
Nódulo displásico de bajo grado: basofilia citoplasmática, leve atipia. Compare
con los hepatocitos regenerativos al otro lado del septo.
Nódulo Displásico de Alto Grado (3,6,7,35) (sinónimo de Hiperplasia Adenomatosa Atípica) (7): lesión nodular (en su mayoría también hipovascular en angiografía y TAC) cuya densidad celular es dos o tres veces la de los nódulos regenerativos circundantes, con trabéculas multicelulares dispuestas irregularmente pero cuya atipia citológica (displasia de células pequeñas) y arquitectural (puede mostrar acinos, focos escirros, nódulos en nódulo, trabéculas gruesas) (fig. 4) y la capilarización parcial de sus sinusoides no son rasgos suficientes para un diagnóstico de carcinoma hepatocelular bien diferenciado. Puede mostrar variable grado de cambio graso. Separar carcinoma hepatocelular bien diferenciado de nódulo displásico de alto grado es problemático y sólo la ausencia de invasión estromal (invasión de hepatocitos tumorales en los tractos portales) (37) es el único rasgo diferencial seguro.
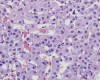
Fig. 4.
Nódulo displásico de alto grado: atipia citológica y arquitectural (acinos).
Transformación nodular parcial: término de uso no recomendado (3) utilizado para nominar una macronodulación limitada al parénquima perihiliar y en torno a los grandes tractos portales intrahepáticos, con conservación de una banda más o menos gruesa del parénquima periférico (38,39). Generalmente se asocia con obstrucciones de grandes vasos venosos portales o arteriales intrahepáticos (39,40).
Transformación nodular no cirrótica: nódulos hepatocelulares de tamaños variables y con distribución variable por el parénquima hepático que se observan en los síndromes de hipertensión portal idiopática o de hipertensión portal no cirrótica (40). Sus características son similares a las de los macronódulos multiacinares pero sin delimitación por septo fibroso circundante. En estos síndromes el grado de fibrosis en el parénquima no nodular es variable pero generalmente escaso.
PROCEDIMIENTOS POSIBLES DE OBTENCIÓN DE MATERIAL TISULAR PARA ESTUDIO CITOHISTOLÓGICO
En la literatura existe una falta de precisión al exponer el tipo de método utilizado para obtener el material biológico que permita el diagnóstico citohistológico de las lesiones ocupantes de espacio en hígado. El estudio citológico suele tratarse de una punción aspiración con aguja fina (PAAF) que consigue una extensión de material celular o bien de una biopsia con aguja de Menghini cuyo calibre puede ser variable y que cuando se acerca al de una aguja fina de punción-aspiración ha recibido el nombre de microbiopsia o biopsia con aguja fina (BAF). En las biopsias se consigue tejido que es procesado por la habitual técnica histológica y que generalmente permite evaluar arquitectura tisular además de caracteres citológicos.
En nuestro hospital se puede recurrir para el estudio citohistológico a:
1. Citología por Punción Aspiración con Aguja Fina (PAAF) de 0,6 mm, procedimiento realizado por el Servicio de Radiología y/o
2. Histología por:
Microbiopsia con Aguja Fina (BAF) de Menghini de 0,8-1,2 mm o
Biopsia con Agujas de Menghini habituales de 1,6 mm o 1,8 mm.
Procedimientos realizados por el Servicio de Medicina de Aparato Digestivo y por el de Radiología.
Elección del procedimiento
Se ha comparado en la literatura la sensibilidad, la especificidad y la precisión diagnóstica de ambos procedimientos. La mayor precisión diagnóstica (91%) se obtiene realizando ambas, PAAF y microbiopsia. La precisión diagnóstica es menor (48%) con PAAF sólo que con microbiopsia sólo (67%) (41).
Objetivos
1. Determinar por uno o más de los anteriores procedimientos:
a) Que se ha obtenido material tisular de la LOE.
b) Que es hepatocelular o no hepatocelular (si no es hepatocelular: salida de este protocolo).
c) Que es maligna o benigna.
2. Determinar si existe cirrosis: en el caso de que este dato no sea concluyente por las exploraciones pertinentes previas, mediante biopsia hepática adicional en parénquima distante de la LOE.
Indicaciones de citohistología
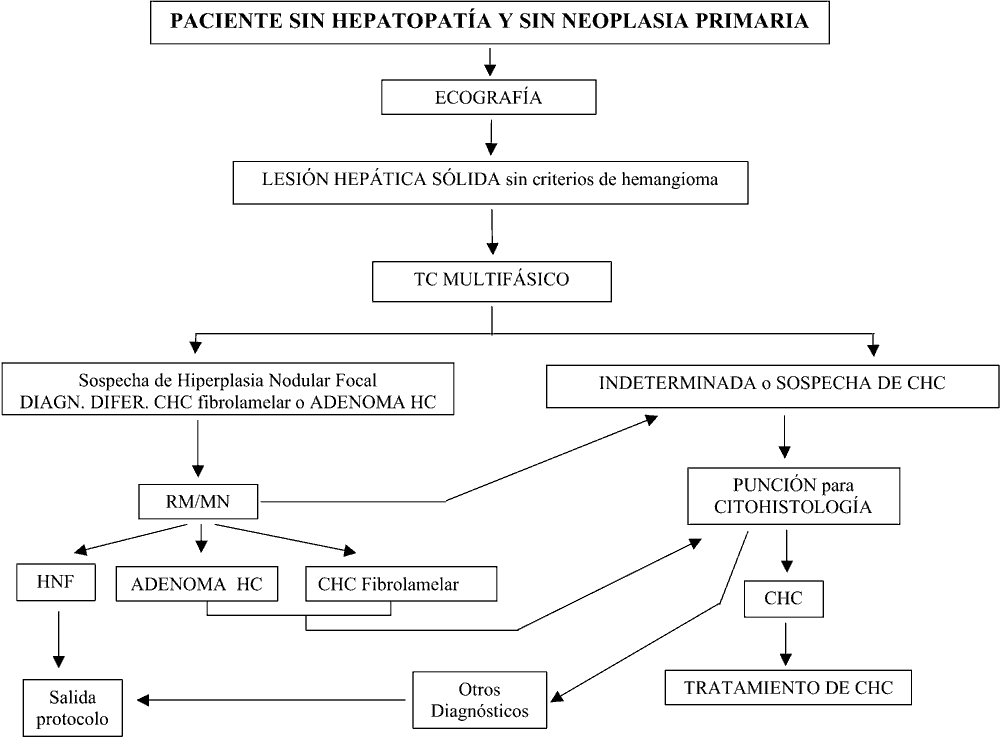
En las situaciones que señalan los algoritmos I y II de diagnóstico:
– Lesiones ocupantes de espacio (LOES) en situación de No-Cirrosis: a) en lesión hepática sólida sin criterios de hemangioma, de naturaleza indeterminada o sospechosa en TC multifásico y con AFP<200 ng/ml, b) en LOE que no cumple criterios de hiperplasia nodular focal con TC multifásico y RM (algoritmo I).
LOE en situación de Cirrosis: a) en lesiones mayores de 2 cm cuando una técnica dinámica de imagen objetiva un patrón vascular atípico de CHC y b) en lesiones entre 1 y 2 cm cuando dos técnicas dinámicas de imagen no muestran un patrón vascular típico de CHC (algoritmo II).
Los nódulos menores de 1 cm requieren seguimiento por US pero no biopsia. Si el nódulo es mayor de 2 cm y tiene características típicas de CHC en técnicas de imagen la biopsia o punción no es necesaria para el diagnóstico de CHC ya que el valor predictivo positivo de la radiología supera el 95%. Si las características de imagen en este tamaño son sospechosas puede requerirse segunda técnica de imagen y estudio citohistológico de confirmación (42,43). Se trata de disminuir el riesgo descrito en la literatura (44-46) de realizar un sembrado de células neoplásicas en el trayecto de la aguja.
MANEJO DEL MATERIAL TISULAR
Especímenes de PAAF: Tras desinfección local de la piel e inserción de la aguja en el/los nódulo/s a considerar, se emplea un tirador CAMECO para sujeción de la jeringa, efectuar vacío y obtener el material adecuado. Este se extiende sobre un portaobjetos y se hace una extensión directa, dejando que el tejido se seque al aire o introduciéndolo de inmediato en alcohol de 96°; también se puede expeler todo el material en medio fijador líquido (Thin-Prep) si la punción fuera muy hemática; los medios líquidos permiten alícuotas para obtener más cantidad de material y hacer los estudios especiales pertinentes.
Biopsias de aguja habituales (Menghini 1,6 ó 1,8 mm): Manejo habitual. Cortar el cilindro en segmentos de 2 cm si es muy largo. Hacer HE y tinciones específicas de tejido hepático: reticulina, Masson, Pas-diastasa y Perls (Shikata y rodanina opcionales).
Microbiopsias (Menghini 0,8 ó 1,2): Recibir de inmediato, colocar el cilindro tisular en «férula» de cartón (para enderezar el cilindro en un plano que permita enfrentar paralelamente todo el tejido a la cuchilla del microtomo y obtener cortes que no lo fragmenten) y envolver en papel. Hacer 15 cortes sin teñir en portas silanizados (posible necesidad de inmunohistoquímica) y un corte teñido con HE. Decidir tinciones histoquímicas e inmunohistoquímicas después de ver un corte teñido con HE.
Piezas de hepatectomía parcial (hepatectomías regladas, mono, bi, trisegmentectomías, resecciones atípicas o subsegmentectomías): Suelen ofrecer extensas superficies de corte quirúrgico que hacen impracticable un estudio exhaustivo de bordes. Conviene seleccionar el muestreo de los mismos después de haberlos teñido con tinta china. Selección recomendable: a) cortes de borde/s quirúrgico/s mas cercano/s al tumor resecado, b) tomar muestras de cortes seriados de la/s zona/s más hiliar/es que incluyan el reconocible septo portal más grande de la segmentectomía o de la lobectomía y c) cortes de todos los septos portales grandes que se identifiquen en la superficies de sección quirúrgica. Técnica histológica habitual con tinciones de tejido hepático en la muestra tisular con transición tumor-no tumor.
Hígados nativos de trasplante y de autopsia. Identificar si existe TIPS (shunt portosistémico intrahepático transyugular), canularlo, abrirlo y comprobar su permeabilidad y después retirar su malla con precaución, dado lo punzante de sus hilos metálicos. Tallar:
a) El corte «maestro»: horizontal desde la desembocadura de las venas suprahepáticas hasta la inserción del ligamento redondo, en el borde hepático anterior, que generalmente expone a la inspección la primera bifurcación de vena porta.
b) Obtener un prisma con cuatro cortes verticales al corte «maestro» que incluya la primera bifurcación de la porta hepatis en el hilio. Seriar este prisma con cortes verticales paralelos de 2-3 mm de espesor de derecha a izquierda y tomar muestras (identificación en ellos de arteria, vena porta, ductos hepáticos y ganglios hiliares).
c) Muestreo de venas suprahepáticas.
d) Muestreo parenquimatoso de los lóbulos, de las lesiones neoplásicas, de los sospechados nódulos displásicos (distintos de los nódulos de su entorno) y de los macronódulos si los hubiera. Muestreo de pared de vesícula biliar. Técnica histológica habitual de tejido hepático en cortes con transición tumor-no tumor.
TÉCNICAS CITOHISTOLÓGICAS E INMUNOHISTOQUÍMICAS
Las tinciones electivas para estudios citológicos son la de Giemsa, variante rápida (QCA), en los frotis secados al aire que permite en tres minutos una evaluación inmediata del material para confirmar si es valorable, representativo y concluyente. También se realiza, en las fijadas en alcohol, la técnica de Papanicolaou que permite, además de hacer el diagnóstico, emplear otras técnicas de tinción especiales e incluso inmunohistoquímicas para inmunomarcaje específico.
Las tinciones electivas son las habituales para biopsias de tejido hepático: hematoxilina-eosina, impregnación argéntica para reticulina, tricrómico, Pas-diastasa y Perls para pigmento férrico. Especial relevancia tiene la tinción de reticulina cuya escasez en lesiones hepatocelulares malignas es un indicio de su comportamiento.
Los criterios morfológicos para el diagnóstico histológico de biopsias y microbiopsias de las lesiones hepatocelulares benignas o malignas se exponen en la selección de definiciones y criterios diagnósticos. Los criterios útiles para el citodiagnóstico de extensiones de PAAF (fig. 5) se exponen en la tabla 1, tomada de Wee, A (47) levemente modificada (48,49).
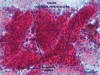
Fig. 5.
Extensión tras PAAF: trabéculas celulares gruesas endotelizadas.

Las técnicas inmunohistoquímicas comprenden un amplio panel de anticuerpos que pueden ayudar al diagnóstico histopatológico de origen tumoral en caso de patrón histológico mal o no diferenciado (ej. anti-hepatocito Hep Par 1), si bien no existen marcadores inmunohistoquímicos que confirmen una malignidad sospechada por la lectura de las otras técnicas histológicas.
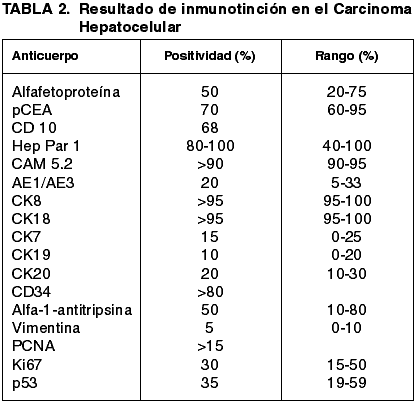
El panel de anticuerpos recomendado (47) incluye alfafetoproteína, antígeno carcinoembriónico policlonal (pCEA), CD10, Hep Par 1, citoqueratinas (CK7, 8, 18, 19 y 20, CAM 5.2, AE1/AE3) y CD34. Pueden utilizarse índices de proliferación celular (PCNA, Ki67) y marcadores endoteliales (CD34, CD31, Factor 8, Ulex Europeus). El porcentaje de positividades de cada anticuerpo se ofrece en la tabla 2. pCEA, CD34 y AFP son especialmente recomendables.
En el momento actual las técnicas moleculares no permiten establecer el diagnóstico entre lesiones premalignas y malignas.
GUÍA PARA LA INTERPRETACIÓN HISTOLÓGICA DE MICROBIOPSIAS (0,8-1,2 mm) Y BIOPSIAS (1,6-1,8 mm) DE AGUJA DE LOES HEPÁTICAS SOSPECHOSAS DE NEOPLASIA HEPATOCELULAR
INFORMACIÓN CLÍNICA NECESARIA: la lesión ocupante de espacio (LOE) se presenta en un hígado cirrótico o en un hígado no cirrótico (si este dato se desconoce y la LOE es hepatocelular, es recomendable la biopsia del parénquima extranódulo). Además de conocer el perfil bioquímico de la función hepática es necesario saber la tasa de AFP. Los informes de las técnicas de imagen (ecografía, TC multifásico, RM) deben ser consultados por el patólogo como un sustituto del estudio macroscópico a la hora de interpretar una biopsia o una PAAF de lesión ocupante de espacio en hígado. Una metodología similar a la que se realiza en la patología tumoral ósea, con la interpretación conjunta por radiólogo y patólogo, es oportuna en la patología tumoral hepática y se llevará a cabo en las reuniones asistenciales habituales de la Subcomisión de Tumores Digestivos.
1.º ¿El tejido observado puede corresponder a una LOE? (Valoración de la idoneidad de la muestra. ¿Se ha muestreado la LOE?):
SÍ: cuando se identifica:
Una lesión no hepatocelular (benigna o maligna) (salida de este protocolo).
Una lesión hepatocelular:
Un carcinoma hepatocelular.
Un adenoma hepatocelular (no posible en cirrosis).
Una hiperplasia nodular focal (no posible en cirrosis).
Un nódulo hepatocelular:
Macronódulo hepatocelular benigno.
Nódulo de una transformación nodular no cirrótica.
Nódulo displásico de alto o de bajo grado.
•Cualquier otro de los posibles diagnósticos referidos en el apartado: Selección de definiciones y criterios diagnósticos lesiones hepatocelulares.
NO (recomendar nueva microbiopsia): cuando se identifica que:
Todo el tejido hepático remitido es sano.
Todo el tejido hepático remitido es cirrosis micronodular.
2.º Si la LOE es una lesión hepatocitaria:
Si es sobre no-cirrosis debe tratarse de:
Un carcinoma hepatocelular.
Un adenoma hepatocelular.
Una hiperplasia nodular focal.
Un nódulo de transformación nodular no cirrótica en un síndrome de hipertensión portal idiopática.
Cualquier otra de las lesiones que se presentan sobre hígado no-cirrótico y referidas en el apartado «Selección de definiciones y criterios diagnósticos lesiones hepatocelulares».
Si es sobre cirrosis (anexo 1) debe tratarse (considerar que en el trasfondo de una cirrosis no se observan metástasis más que excepcionalmente) (50) de:
Un macronódulo hepatocelular benigno.
Un nódulo displásico de bajo o de alto grado.
Un carcinoma hepatocelular
Si no es un claro carcinoma hepatocelular la situación es la de mayor dificultad porque no podrá determinarse si la biopsia es representativa de todo el nódulo:
a) Siendo benigna ¿la benignidad histológica es de todo el nódulo?
b) Siendo atípica ¿ la displasia objetivada es la máxima atipia del mismo?
3.º En esta última situación diagnóstica la decisión se plantea entre resección quirúrgica o seguimiento ecográfico periódico (trimestral-semestral) para objetivar variaciones de tamaño o de ecogenicidad en la lesión e indicar posterior repetición de estudio citohistológico.
ESTADIFICACIÓN PATOLÓGICA
La estratificación de pacientes por grupos tiene interés pronóstico y el estadio tumoral condiciona el tipo de terapéutica a aplicar. El CHC asienta frecuentemente sobre hígados afectos de hepatopatía crónica o cirrosis en distintos estadios de descompensación. Esta circunstancia determina que, a diferencia de otras neoplasias de órgano sólido, la historia natural del CHC se vea condicionada no sólo por la extensión tumoral, sino también, y de forma determinante, por el grado de insuficiencia hepatocelular en el momento de su diagnóstico. Por ello la extensión tumoral es un modelo pronóstico unidimensional que no contempla el estado de la reserva funcional hepática. Okuda et al (51) en 1985 diseñaron el primer sistema estadificador que consideraba como un parámetro más la función hepática residual. La clasificación de la American Joint Committee on Cancer TNM (52) no es por tanto tan útil como otros sistemas de estadificación para el CHC. No obstante el TNM patológico se sigue manteniendo obligatorio en los informes anatomopatológicos de las piezas con CHC remitidas a nuestro laboratorio (anexo 3), y ello porque es una norma hospitalaria de calidad que dicho sistema se haga constar para toda pieza de resección quirúrgica de tumores malignos, cualquiera que sea su topografía.

Para el CHC la Subcomisión de Tumores Digestivos ha decidido que clínicamente se utilice el sistema estadificador Barcelona Clinic Liver Cancer (BCLC) (53), que considera la situación general del paciente (performance status del ECOG –tabla 4–) y la situación funcional hepática como parámetros para estadificar.

Por lo que respecta al patólogo, se hace preceptivo que en los informes de las piezas de resección, además de la estadificación obligatoria exigible por las citadas normas de calidad (TNMp), conste la siguiente relación de datos pronósticos útiles para la estadificación BCLC:
Tipo histológico del CHC.
Grado de diferenciación.
Localización: lóbulo izquierdo, derecho, ambos. Multicentricidad si la hubiera (ver criterios en la selección de definiciones).
Extensión:
Número de nódulos tumorales: solitario, paucifocal (3 nódulos), multifocal (>3 nódulos) o masivo o difuso.
Ganglios positivos/total ganglios estudiados.
Metástasis extraganglionares.
Invasión vascular.
Trombosis y/o invasión tumoral de la mayor rama de la vena porta estudiada y de las venas suprahepáticas.
BIBLIOGRAFÍA
Ruby SJ. Protocol for the examination of specimens from patients with hepatocellular carcinoma and cholangiocarcinoma, including intrahepatic bile ducts. Cancer Committee of the College of American Pathologists. Arch Pathol Lab Med 2000; 124: 41-5.
Colina F, Ibarrola C. Protocolo y guía para el diagnóstico histopatológico de hepatocarcinoma. Subprotocolo de Anatomía Patológica para un protocolo general hospitalario de hepatocarcinoma. Rev Esp Patol 2001; 34: 265-75.
International Working Party: Terminology of nodular hepatocellular lesions. Hepatology 1995; 22: 983-93.
Chiche L, Dao T, Salame E, Galais MP, Bouvard N, Schmutz G, et al. Liver adenomatosis: Reappraisal, diagnosis, and surgical management. Eight new cases and review of the literature. Ann Surg 2000; 231: 74-81.
Grazioli L, Federle MP, Ichikawa T, Balzano E, Nalesnik M, Madariaga J. Liver adenomatosis: Clinical, histopathologic, and imaging findings in 15 patients. Radiology 2000, 216: 395-402.
Kondo F, Hirooka N, Wada K, Kondo Y. Morphological clues for the diagnosis of small hepatocellular carcinomas. Virchows Arch A 1987; 411: 15-21.
Takayama T, Makuuchi M, Hirohashi S, Sakamoto M, Yamamoto J, Shimada K, KosugeT, Okada S, Takayasu T, Yamasaki S. Early hepatocellular carcinoma as an entity with a high rate of surgical cure. Hepatology 1998; 28: 1241-6.
Kojiro M, Nakashima O. Histopathologic evaluation of hepatocelular carcinoma with special reference to small early stage tumors. Sem Liver Dis 1999; 19: 287-96.
Nakashima Y, Osamu Nakashima, Masatoshi Tanaka, Koji Okuda, Miwako Nakashima and Masamichi Kojiro. Portal vein invasion and intrahepatic micrometastasis in small hepatocellular carcinoma by gross type. Hepatol Res 2003; 26: 142-7.
Libbrecht L, Desmet V, Roskams T. Preneoplastic lesions in human hepatocarcinogenesis. Liver Int 2005; 25: 16-27.
Caturelli E, Solmi L, Anti M, Fusilli S, Roselli P, Andriulli A, Fornari F, Del Vecchio C, Blanco I, de Sio I. Ultrasound guided fine needle biopsy of early hepatocellular carcinoma complicating liver cirrhosis: a multicentre study. Gut 2004; 53: 1356-62.
Kojiro M. Premalignant lesions of hepatocellular carcinoma: pathologic viewpoint. J Hepatobiliary Pancreat Surg. 2000; 7: 535-41.
Hirohashi T, Ishak KG, Kojiro M, Wanless IR, et al. Pathology and genetics of tumours of the digestive system. In: Hamilton SR, Aalton LA (eds). World Health Organization Classification of tumours. Lyon: IARC Press; 2000. p. 157-72.
Edmonson HA, Steiner PE. Primary carcinoma of the liver: a study of 100 cases among 48900 necropsies. Cancer 1954; 7: 462-503.
Craig JR, Peters RL, Edmonson HA, Omata M. Fibrolamellar carcinoma of the liver: a tumor of adolescents and young adults with distinct clinicopathologic features. Cancer 1980; 46: 372-9.
Huang GT, Sheu JC, Lee HS, Lai MY, Wave TH, Chen DS. Icteric type hepatocellular carcinoma: Revisited 20 years later. J Gastroenterol 1998, 33: 53-6.
Taguchi J, Nakashima O, Tanaka M, Hisaka T, Takazawa T, Kojiro M. A clinicopathological study on combined hepatocellular and cholangiocarcinoma. J Gastoenterol Hepatol 1996, 11. 758-64.
Wu PC, Fang JW, Lau VK, Lai CL, Lo CK, Lau JY. Classification of hepatocellular carcinoma according to hepatocellular and biliary differentiation markers. Clinical and biological implications. Am J Pathol 1996; 149: 1167-75.
Wittekind C, Fischer HP, Ponchon T. Pathology and genetics of tumours of the digestive system. In: Hamilton SR, Aalton LA, editores. World Health Organization Classification of tumours. Lyon: IARC Press; 2000. p. 181.
Omata M, Peters RL, Tatter D. Sclerosing hepatic carcinoma: relationship to hypercalcemia. Liver 1981; 1: 33-49.
Wada Y, Nakashima O, Kutami R, Yamamoto O, Kojiro M. Clinicopahological study on hepatocellular carcinoma with lymphocytic infiltration. Hepatology 1998; 27: 407-14.
Kojiro M, Sugihara S, Kakizoe S. Hepatocellular carcinoma with sarcomatous change: a special reference to the relationship wit anticancer therapy. Cancer Chemoter Pharmacol 1989; 23 (Suppl.): 4-8.
Yang SH, Watanabe J, Nakashima O, Kojiro M. Clinicopahologic study on clear cell hepatocellular carcinoma. Pathol Int 1996; 46: 503-9.
Anthony PP, Bannasch P. Tumours and tumour-like lesions of the liver and biliary tract. En: Pathology of the liver. MacSween RNM, editor. Edinburgh: Churchill Livingstone; 1994. p. 635-711.
Anthony PP, Ishak KG, Nayak NC, Poulsen HE, Scheuer PJ, Sobin LH. The morphology of cirrhosis: definition, nomenclature and classification. Bull WHO 1977; 55: 521-50.
Ludwig J. Terminology of chronic hepatitis, hepatic allograft rejection, and nodular lesions of the liver: Summary of recommendations developed by an International Working Party, supported by the World Congresses of Gastroenterology, Losa Angeles,1994. Am J Gastroenterol 1994; 89: S177-81.
Anthony PP, Vogel CL, Barker LE. Liver cell dysplasia: a premalignant condition. J Clin Pathol 1973, 26: 217-23.
Anthony PP. Precursor lesions for liver cancer in humans. Cancer Research 1976; 36: 2579-83.
Lee RG, Tsamandas AC, Demetris AJ. Large cell change (liver cell dysplasia) and hepatocellular carcinoma in cirrhosis: Matched case-control study, pathological analysis and pathogenetic hypothesis. Hepatology 1997; 26: 1415-22.
Watanabe S, Okita K, Harada T, Kodama T, Numa Y, Takemoto T, et al. Morphological studies of the liver cell dysplasia. Cancer 1983; 51: 2197-05.
Su Q, Benner A, Hofmann WJ, Otto G, Pichlmayr R, Bannasch P. Human hepatic preneoplasia: phenotypes and proliferation kinetic of foci and nodules of altered hepatocytes and their relationship to liver cell dysplasia. Virchows Arch 1997; 431: 391-406.
Altmann HW. Epithelial and mixed hepatoblastoma in the adult. Histological observations and general considerations. Path Res Pract 1992; 188: 16-26.
Wanless IR, Albrecht S, Bilbao J, Frei JV, Heathcote EJ, Roberts Ea, Chiasson D. Multiple focal nodular hyperplasia of the liver associated with vascular malformations of various organs and neoplasia of the brain: a new syndrome. Mod Pathol 1989; 2: 456-62.
Wanless IR. Micronodular transformation (nodular regenerative hyperplasia) of the liver: A report of 64 cases among 2,500 autopsies and a new classification of benign hepatocellular nodules. Hepatology 1990; 11: 787-97.
Hytiroglou P, Theise ND. Differential diagnosis of hepatocellular nodular lesions. Sem Diag Pathol 1998; 15: 285-99.
Ferrell LD, Crawford JM, Dhillon AP, Scheuer PJ, Nakanuma Y. Proposal for standardized criteria for the diagnosis of benign, borderline, and malignant hepatocellular lesions arising in chronic advanced liver disease. Am J Surg Pathol 1993; 17: 1113-23.
Kojiro M, Roskams T. Early hepatocellular carcinoma and dysplastic nodules. Semin Liv Dis 2005; 25: 133-42.
Sherlock S, Feldman Ca, Scheuer PJ. Partial nodular transformation of the liver with portal hypertension. Am J Med 1966; 40: 195-203.
Nakanuma Y. Non-neoplastic nodular lesions in the liver. Pathology International 1995; 45: 703-14.
Nakanuma Y, Hoso M, Sasaki M, Terada T, Katayanagi A, Nonomura A, Kurumaya H, Harada A, Obata H. Histopathology of the liver in non-cirrhotic portal hypertension of unknown aetiology. Histopathology 1996; 28: 195-204.
Borzio M, Borzio F, Macchi R,Croce AM, Bruno S, Ferrari A, Servida R. The evaluation of fine-needle procedures for the diagnosis of focal liver lesions in cirrhosis. J Hepatol 1994; 20: 117-21.
Bruix J, Sherman M. Management of hepatocellular carcinoma. Hepatology 2005; 42: 1208-36.
Levy I, Greig PD, Gallinger S, Langer B, Sherman M. Resection of hepatocellular carcinoma without preoperative tumor biopsy. Ann Surg 2001; 234: 206-9.
Schotman SN, De Man RA, Stoker J, Zondervan PE, Ijzermans JNM. Subcutaneous seeding of hepatocellular carcinoma after percutaneous needle biopsy. Gut 1999; 45: 626-7.
Takamori R, Wong LL, Dang C, Wong L. Needle-tract implantation from hepatocellular cancer: Is needle biopsy of the liver always necessary? Liver Transpl 2000; 6: 67-72.
Souto E, Gores GJ. When should a liver mass suspected of being a hepatocellular carcinoma be biopsied?. Liver Transpl 2000; 6: 73-5.
Wee A. Distinction between well-differenciated hepatocellular carcinoma and benign hepatocellular nodular lesions using fine-needle aspiration biopsy. Molecular genetics: Liver and pancreatic carcinomas. Handbook of Immunochemistry and in situ hybridization of human carcinomas. Vol 3. London: Elsevier Inc.; 2005, p. 247-59.
Lundquist A : Fine leedle aspiration biopsy of the liver. Applications in clinical diagnosis and investigation. Acta Med Scand Suppl 1971; 520: 1-28.
Das DK: Cytodiagnosis of hepatocellular carcinoma in fine needle aspirates of the liver : its differentiation from reactive hepatocytes and metastatic adenocarcinoma. Diagn Cytopathol 1999; 21: 370-7.
Uetsuji S, Yamamura M, Yamamichi K, Okuda Y, Takada H, Hioki K. Absence of colorectal cancer metatasis to the cirrhotic liver. Am J Surg 1992; 164: 176-7.
Okuda K, Ohtsuki T, Obata H, Tomimatsu M, Okazaki N, Hasewaga H, et al. Natural history of hepatocellular carcinoma and prognosis in relation to treatment. Cancer 1985; 56: 918-28.
International Union Against Cancer. TNM classification of malignant tumours: Liver (ICD-O C22). En: Sobin LH, Wittekind Ch, editores. 6.a ed. New York: Wiley-Liss; 2002. p. 81-3.
Llovet JM, Brú C, Bruix J. Prognosis of hepatocellular carcinoma: the BCLC staging classification. Semin Liver Dis 1999; 19: 329-38.
ANEXO 1: NODULOS SOSPECHOSOS EN CIRROSIS
Nódulos hepatocelulares que son
distintos del parénquima circundante (por tamaño, por textura, por color , por
rebosamiento al corte). El diagnóstico de CHC es sólo microscópico.
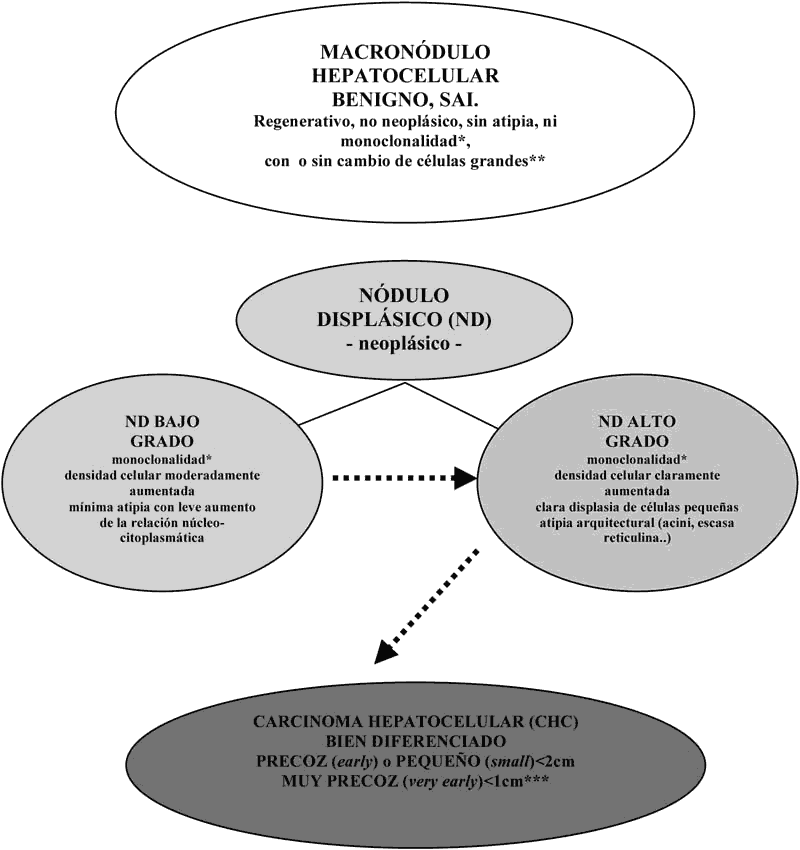
* Por monoclonalidad se entiende que toda o parte
de la población de sus hepatocitos presenta rasgos (fenotipo) distintos de la
población fuera del nódulo.
** La llamada displasia de Anthony (cambio de células grandes) es considerada
hoy como un cambio reactivo mas que como una lesión preneoplásica en si misma.
No obstante su significado pronóstico para el paciente puede ser de valor ya que
se asocia con mayor riesgo de transfomación maligna en otra zona del hígado que
la alberga.
*** CHC «in situ» (sin destrucción de la trama reticulínica) se ha empleado como
un subtipo de CHC pequeño.
Mayor malignidad
------------------------>
Menor diferenciación
ANEXO 2: CLASIFICACIÓN HISTOLÓGICA DE LA OMS DE LOS TUMORES HEPÁTICOS EPITELIALES Y CODIFICACIONES SNOMED (T56000) (17)
Benignos
| – Adenoma hepatocelular | M81700 |
| – Hiperplasia nodular focal | M81600 |
| – Adenoma intrahepático de ductos biliares | M81600 |
| – Cistadenoma intrahepático de ductos biliares | M81610 |
| – Papilomatosis biliar | M82640 |
Malignos
| – Carcinoma hepatocelular | M81703 |
| – Colangiocarcinoma intrahepático | M81603 |
| – Cistadenoacarcinoma intrahepático de ductos biliares | M81613 |
| – Hepatocolangiocarcinoma | M81803 |
| – Hepatoblastoma | M89703 |
| – Carcinoma indiferenciado | M80203 |
Alteraciones epiteliales
|
– Displasia hepatocitaria |
M74000* |
|
– Nódulo displásico (hiperplasia adenomatosa) |
M81702* |
|
– Alteraciones de los ductos biliares |
M85002 |
* No ofrecidos por la OMS. Decididos provisionalmente para uso interno hospitalario.
ANEXO 3: CLASIFICACIÓN TNM DE LOS TUMORES MALIGNOS HEPÁTICOS (ICD-O C22) (52)
T - Tumor primario
El tumor primario no puede ser evaluadoTX
N - Ganglios regionales (hiliares, hepáticos –en torno de la arteria hepática– y los de vena cava (en torno a la misma y por encima de la vena renal (no los subfrénicos)
Los ganglios regionales no pueden ser evaluadosNX
M - Metástasis distantes
Metástasis distantes no pueden ser evaluadasMX
Algoritmo 1
Algoritmo 2