
Vol. 39, n.º 2, 2006
REVISTA
ESPAÑOLA DE
Vol. 39, n.º 2, 2006 |
REVISIONES
Francisco José Martínez Tello1, Palmira Manjón Luengo2, Santiago Montes Moreno1
Hospital Universitario 12 de Octubre de la
Universidad Complutense de Madrid.
1 Departamento de
Anatomía Patológica.
2 Servicio de
Radiodiagnóstico.
fmartinez.hdoc@salud.madrid.org
RESUMEN
El término condrosarcoma es usado para describir un grupo heterogéneo de tumores con características morfológicas y comportamientos clínicos diversos. Se asume que los condrosarcomas son tumores malignos constituidos por células de fenotipo cartilaginoso que usualmente muestran un patrón histológico lobulado y tienden a mantener su naturaleza esencialmente cartilaginosa a lo largo de su evolución, independientemente de la localización del tumor, tanto en los tumores esqueléticos como extraesqueléticos. Se reconocen una serie de variantes, de características morfológicas, radiológicas y clínicas diferentes. En esta revisión se exponen las referidas características de las diferentes variantes de condrosarcoma, y las dificultades diagnósticas para el patólogo, haciendo énfasis en los criterios para su diagnóstico diferencial, incluyendo los nuevos conocimientos de citogenética y patología molecular.
Palabras clave: condrosarcoma, del esqueleto acral, de células claras, yuxtacortical, secundarios, mesenquimal, mixoide extraesquelético.
SUMMARY
The term chondrosarcoma is used for describing a heterogeneous group of tumors with diverse morphological features and clinical behaviour. It is assumed that chondrosarcomas are malignant tumors composed of cells with a cartilaginous phenotype that usually show a lobulated histological pattern and tend to maintain their essentially cartilaginous nature along their evolution, independently of the site of the tumor, as well in osseous as in extra skeletal tumors. Several variants of chondrosarcomas are recognized. They have different morphological, radiological and clinical features. In this revision the above mentioned features of the different variants and the diagnostic difficulties for the pathologist are commented, and emphasis is given to the criteria for its differential diagnosis, including recent knowledge about cytogenetics and molecular biology.
Key words: chondrosarcoma, acral skeleton, clear cell chondrosarcoma, juxtacortical chondrosarcoma, secondary chondrosarcoma, mesenchymal chondrosarcoma, extra skeletal myxoid chondrosarcoma.
INTRODUCCIÓN
El condrosarcoma es definido como un tumor maligno con diferenciación de cartílago hialino puro que puede presentar cambios mixoides, calcificación y osificación (1). Se consideran una serie de variantes de condrosarcoma que constituyen entidades clinicopatológicas diferenciadas. Cada una de ellas presenta una evolución y pronóstico diferentes que requieren también un tratamiento distinto.
Se reconocen las siguientes variantes de condrosarcoma: 1. Condrosarcoma primario convencional o central. 2. Condrosarcoma del esqueleto de manos y pies o acral. 3. Condrosarcoma de los huesos del macizo craneofacial. 4. Condrosarcoma de las edades infantil y juvenil. 5. Condrosarcoma yuxtacortical o periostal. 6. Condrosarcoma central secundario en la encondromatosis múltiple, en la enfermedad de Ollier y síndrome de Maffucci. 7. Condrosarcoma periférico secundario. 8. Condrosarcoma de células claras. 9. Condrosarcoma Desdiferenciado. 10. Condrosarcoma sinovial. 11. Condrosarcoma de laringe. 12. Condrosarcoma mesenquimal. 13. Condrosarcoma mixoide extraesquelético.
El condrosarcoma primario convencional central constituye aproximadamente el 20% de los tumores óseos malignos primarios, tras el mieloma y el osteosarcoma. El 90% de todos los condrosarcomas son centrales primarios. Las localizaciones más frecuentes son la pelvis, seguida del fémur proximal, húmero proximal y costillas, siendo extremadamente raro en columna y huesos craneofaciales. Es una neoplasia cartilaginosa maligna de localización central, intramedular, que macroscópicamente tiende a mostrar un aspecto hialino, color gris azulado y un patrón nodular. También puede contener áreas mixoides, quísticas o focos o zonas calcificadas amarillento-blanquecinas. En el hueso seccionado se pueden encontrar focos de erosión del córtex, destrucción de la cortical y extensión a los tejidos blandos adyacentes, especialmente en los tumores localizados en huesos planos (fig. 1). Histológicamente estos tumores observados a pequeño aumento muestran un patrón lobular, de lóbulos de tamaño y configuración variables, como es la regla en todos los tumores de estirpe condral, malignos y benignos. Los lóbulos se encuentran separados por bandas de tejido fibroso o permean los espacios medulares entre las trabéculas óseas preexistentes, un hecho de enorme valor para el diagnóstico diferencial con tumores benignos (condromas), sobre todo en biopsias con escaso tejido, como las realizadas con trocar. Los condrosarcomas son hipercelulares comparados con los condromas y presentan una atipia variable (1-3).
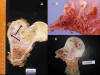
Fig. 1: A)
Pieza quirúrgica de resección de la extremidad proximal de fémur derecho con
condrosarcoma bien diferenciado que ha destruido extensamente el hueso esponjoso
y ha producido erosiones endósticas (muerdos endósticos) del hueso cortical
(flechas). B) Pieza de resección quirúrgica de clavícula con condrosarcoma. C)
Pieza de resección quirúrgica del segundo dedo de la mano derecha con
condrosarcoma central secundario en un paciente con encondromatosis múltiple.
Es mandatorio establecer el grado histológico, ya que éste es el mejor parámetro para conocer la evolución y pronóstico en cada caso y también para determinar las pautas terapéuticas (4). Los condrosarcomas se gradúan en una escala de 1 a 3. Los condrosarcomas grado 1 presentan una celularidad moderada, hallándose células de núcleos, grandes, hipercromáticos y bizarros y células binucleadas. Los grado 2 presentan una celularidad más abundante, un mayor grado de atipia celular y se pueden encontrar en ellos algunas mitosis, aunque no siempre. Los grado 3 son mucho más celulares que los grado 2, presentan una marcada atipia celular y siempre mitosis, que se encuentran fácilmente y que pueden ser atípicas (fig. 2). Ocasionalmente se pueden encontrar en el mismo tumor áreas con diferente grado histológico. La mayoría de los condrosarcomas son tumores de bajo grado de malignidad, grados 1 ó 2. Los condrosarcomas de bajo grado con cambios mixoides se deben clasificar como grado 2 (2). El diagnóstico histológico de los tumores grados 2 y 3 es fácil. Sin embargo, el diagnóstico de los grado 1 puede ser extremadamente difícil o incluso imposible. Por ello se acuñó el término de tumor cartilaginoso «borderline», que se debe evitar utilizar. El término «borderline» quiere indicar que se trata de un tumor en el que es incierto predecir su comportamiento basándose únicamente en las características histológicas. En estos casos es fundamental considerar la localización y las características radiológicas del tumor para llegar a una conclusión diagnóstica de benignidad o malignidad (2).

Fig. 2: A)
y B) Condrosarcomas grado 1. A) Microfotografía a mediano aumento en la que se
aprecia una celularidad superior a la que se encuentra en un encondroma. En B
microfotografía a mayor aumento ( x100, HE) que muestra abundantes células
binucleadas (flechas). C) Condrosarcoma grado 2 que muestra una celularidad
mayor que el grado 1, abundantes células de núcleos grandes e hipercromáticos y
alguna mitosis (flecha). D) Condrosarcoma grado 4 que muestra una gran densidad
celular, pleomorfismo y atipia nuclear y mitosis. Las microfotografías A, C y D
han sido realizadas con el mismo aumento (x65,5; HE).
Algunos tumores pueden aparentar malignidad si se aplican los criterios histológicos convencionales. Es el caso de los condromas de los pequeños huesos de manos y pies, condromas periostales, condromas en la encondromatosis múltiple, enfermedad de Ollier y síndrome de Maffucci, condromatosis sinovial o condromas de los tejidos blandos de las manos y pies. Los tumores cartilaginosos con hipercelularidad baja, leve atipia nuclear, consistente en la presencia de núcleos de mayor tamaño e hipercromáticos, no deben de ser considerados malignos si se encuentran localizados en los dedos de las manos o de los pies. Por el contrario, los tumores cartilaginosos del esternón son todos malignos, casi sin excepción, independientemente de las características histológicas que tengan. En general las neoplasias cartilaginosas localizadas en el esqueleto axial o en los huesos tubulares largos del esqueleto apendicular son usualmente malignas, en tanto que las localizadas en las partes acras del esqueleto apendicular son usualmente benignas (1-3, 5). Los condrosarcomas múltiples son excepcionales, habiéndose solamente referido 15 casos en la literatura mundial (6).
La radiología es fundamental en la valoración diagnóstica de las lesiones óseas pero lo es especialmente en los tumores de estirpe condral. Los tumores cartilaginosos muestran lesiones radiolúcidas que cuando se mineralizan muestran opacidades punteadas o muy característicamente en forma de anillos o bolas, lo cual es la expresión de la calcificación de los nódulos cartilaginosos que conforman histológicamente el tumor. El comportamiento agresivo de un tumor cartilaginoso se refleja por la presencia de erosiones o «muerdos» endósticos del córtex. En los huesos tubulares largos los condrosarcomas ocurren en la metáfisis y diáfisis donde causan una expansión fusiforme y engrosamiento cortical (fig. 3). En los huesos planos se produce tempranamente la destrucción de la cortical y afectación de los tejidos blandos (1-3,5).
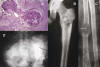
Fig. 3: Correlación
histológica-radiológica. A) Condrosarcoma de bajo grado (x10, HE). Se observan
dos nódulos que aparecen parcialmente calcificados. B) Rx de Condrosarcoma
central de fémur. Extensa lesión lítica de bordes mal definidos, situada en la
región subtrocantérea femoral con extensión caudal hacia la diáfisis. Produce
calcificaciones grumosas en bolas, rebaje endóstico y engrosamiento cortical. C)
Condrosarcoma secundario a encondromatosis múltiple. Rx de antebrazo. Extensa
lesión lítica con muerdos endósticos, afectando a gran parte de la diáfisis del
radio. En la zona central se ha desarrollado un condrosarcoma secundario,
obsérvese insuflación con adelgazamiento cortical, calcificaciones puntiformes y
fractura patológica. D) Rx de pelvis. Condrosarcoma del iliaco izquierdo con
gran masa de partes blandas con calcificaciones puntiformes, en arcos y en
anillos. La calcificación de todo un nódulo proporciona radiológicamente la
imagen de bolas esclerosas que se observan en B y C (flechas). Las áreas en que
el tumor no se encuentra calcificado aparecen líticas. Los nódulos en los que la
calcificación ocurre en la periferia del nódulo proporcionan imágenes en coma o
arco (flecha) o en anillo (cabeza de flecha).
Otro factor importante a tener en cuenta es la edad del paciente. Los condrosarcomas de bajo grado son usualmente tumores de las edades adulta y avanzada, siendo infrecuentes en la tercera década y excepcionales en individuos de menos de 20 años (1-3,5).
En el diagnóstico diferencial del condrosarcoma central con el encondroma, además de los criterios citológicos mencionados, es esencial considerar los patrones histopatológicos básicos de ambos tumores (7). Los encondromas aparecen constituidos usualmente por lóbulos de cartílago de tamaño pequeño a moderado, generalmente independientes entre sí y separados por cantidades variables de tejido óseo y médula ósea normales. Por el contrario los condrosarcomas presentan un patrón permeativo, consistente, en grandes lóbulos de tejido condral neoplásico, confluentes, que permean los espacios medulares entre las trabéculas de hueso normal preexistente, sustituyendo al tejido medular normal. Entre los lóbulos confluentes se pueden formar bandas de fibrosis. Otro patrón virtualmente diagnóstico de condrosarcoma es la infiltración y compresión de la médula adiposa por células cartilaginosas aisladas en los frentes de invasión del tumor. Dichas características sólo se observan rarísima vez en los encondromas, pero éste no es el caso en la enfermedad de Ollier. Finalmente el masivo crecimiento confluente tumoral en los condrosarcomas puede reemplazar el hueso huésped en campos completos de pequeño aumento e infiltrar los conductos de Havers del córtex (fig. 4).

Fig. 4: Patrones
de crecimiento de encondroma (A) y condrosarcoma (B, C y D). A) Cilindro de
biopsia por punción que muestra nódulos de tejido condral en la médula
esponjosa, no confluentes (x5, HE). B) Cilindro que muestra un patrón
histológico confluente (x8, HE). C) Imagen de condrosarcoma bien diferenciado
que muestra nódulos separados por bandas fibrosas (flechas) (x20, HE). D)
Condrosarcoma que permea los espacios medulares rodeando y engastando a las
trabéculas óseas ( x50, HE). En el inset detalle que muestra la infiltración de
la médula adiposa por el tumor.
El problema diagnóstico más común con el condrosarcoma primario central convencional, localizado en un hueso tubular largo, es cuando el patólogo se encuentra ante un tumor en el que sus características citológicas y de tamaño no presentan criterios suficientes para concluir que se trata de una neoplasia maligna, es decir que se encuentra ante un tumor «borderline». En general se debe sospechar que un tumor borderline sea un condrosarcoma si radiológicamente se aprecia alteración del patrón trabecular en el hueso esponjoso adyacente, usualmente por pérdida de las trabéculas óseas, reabsorción endóstica de la cortical, manifestada por la presencia de muerdos endósticos, y reacción esclerosa con engrosamiento del córtex, en un paciente con dolor local, especialmente si es en reposo (2).
Los condrosarcomas acrales son infrecuentes por lo que hay que enfatizar la necesidad de consulta entre patólogo y radiólogo. Una lesión cartilaginosa solitaria del esqueleto acral hay que sospechar que sea un condrosarcoma si histológicamente muestra una celularidad aumentada con múltiples células grandes («plump») con una estructura nuclear abierta y atípica. No obstante tales características no son sin embargo diagnósticas de malignidad. Tal lesión sólo debería considerarse un condrosarcoma si se encuentra además histológicamente un patrón de crecimiento infiltrante y destructivo que es confirmado radiológicamente. Tambien, el dolor es un síntoma clínico que aparece en prácticamente todos los casos. El problema se complica porque una resección adecuada (tal como la amputación de un dedo, o del radio afectado, o de parte de toda la mano o del pie, según esté indicado por la localización y extensión del tumor), proporciona una buena posibilidad de cura. Los tratamientos con curetaje, una ablación incompleta o cualquier procedimiento que no sea una resección completa de estos sarcomas no han obtenido éxito (8).
Condrosarcomas de los huesos craneofaciales. Es importante recordar que los tumores cartilaginosos de estas localizaciones son en su gran mayoría malignos, pero en total son raros constituyendo el 2% de todos los condrosarcomas. Típicamente ocurren en la base del cráneo. En general son histológicamente condrosarcomas de bajo grado (9). También es importante recordar que la mayoría de los tumores que contienen cartílago en el maxilar superior y mandíbula son osteosarcomas condroblásticos, lo que hay que tener en cuenta en el diagnóstico diferencial (2). En tanto que los osteosarcomas del esqueleto facial ocurren a una edad mucho más avanzada que en el resto del esqueleto, los condrosarcomas aparecen a edades más tempranas, con una incidencia máxima en la cuarta década; en contraposición los condrosarcomas del esqueleto postcraneal ocurren en la 5.ª y 6.ª décadas. Los condrosarcomas de la base del cráneo deben ser diferenciados del cordoma condroide (2). En general son tumores de curso lento, localmente agresivos pero que rara vez producen metástasis. Como todos los condrosarcomas son resistentes a la radioterapia y la quimioterapia no es eficaz, su tratamiento es quirúrgico, que dada su localización puede ser muy complicado y en numerosos casos no se logra una resección radical, lo cual es causa de recidivas. Las metástasis hematógenas se producen raramente y los pacientes fallecen más frecuentemente como resultado del crecimiento penetrante de un tumor recurrente (9).
Condrosarcomas de las edades infantil y juvenil. Aunque es conocido que el condrosarcoma es un tumor que generalmente ocurre en las edades adultas existe un cierto número de casos que afectan a individuos en la 1.ª y 2.ª décadas. Huvos refiere que en la casuística del Memorial Sloan –Kettering Cancer Center de 1928-1982 se recogieron 493 casos de condrosarcoma y de ellos 21 correspondieron a pacientes menores de 21 años (16%). En ese estudio se obtuvieron las siguientes conclusiones de interés: 1- En general los condrosarcomas que afectan a individuos jóvenes tienen un peor pronóstico, lo cual se corresponde con 2- que presentan un porcentaje más alto de tumores de alto grado histológico (grado 3) y 3- que presentan localizaciones diferentes a las del adulto. En individuos jóvenes, los condrosarcomas son más frecuentes en los huesos craneofaciales y en los huesos de las extremidades que en los adultos y por el contrario en los adultos son más frecuentes los tumores localizados en costillas, esternón y huesos del cinturón pélvico (9).
Condrosarcoma yuxtacortical (Periostal) (fig. 5). Es un tumor raro que ocurre en adultos, en la superficie del hueso, en la metáfisis de los huesos tubulares largos, especialmente del fémur. El tumor debuta clínicamente con dolor. Las radiologías simples muestran una masa tumoral radiolúcida adyacente al córtex que generalmente mide más de 5 cm y presenta calcificaciones focales, frecuentemente acompañadas por espículas perpendiculares a la superficie ósea y triángulos típicos de Codman. Histológicamente el tumor muestra un patrón lobular, aparece generalmente bien delimitado en la superficie y rara vez infiltra el córtex. Se encuentran frecuentemente focos de calcificación y áreas de osificación endocondral pero no de depósito del llamado «osteoide maligno», de fino osteoide en encaje «fine lace like osteoid», por las células neoplásicas (11). El diagnóstico diferencial hay que establecerlo en ocasiones con el condroma periostal, el condrosarcoma periférico secundario y especialmente con el osteosarcoma periostal. El condroma periostal es más frecuente que el condrosarcoma yuxtacortical y afecta más frecuentemente a huesos tubulares cortos de manos y pies, aunque tambien ocurre en huesos tubulares largos. El condroma periostal suele presentar menor tamaño (menos de 5 cm) y una mayor celularidad que el encondroma convencional pero no la atipia del condrosarcoma yuxtacortical (12). En el condrosarcoma secundario periférico en la mayoría de los casos es todavía reconocible el pedículo de hueso esponjoso en continuación con la esponjosa de la cavidad medular subyacente. El osteosarcoma periostal es un osteosarcoma de predominio condroblástico, de grado histológico intermedio (2,3), que presenta características radiológicas bastante similares a las del condrosarcoma yuxtacortical pero que histológicamente, aunque el componente cartilaginoso predomina, siempre se encuentran espículas de osteosarcoma que discurren perpendiculares a la superficie ósea, entre formaciones lobulares condrales que presentan grados variables de atipia y prestan una imagen que ha sido descrita como de plumaje («feathery»). Las formaciones lobulares condrales tienen una abundancia celular y atipia celular mayores en la superficie y el osteoide tumoral puede ser muy escaso (13).
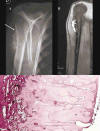
Fig. 5: Condrosarcoma
periostal. A) Radiografía simple. Masa yuxtacortical con calcificaciones
condrales y osificación que produce excavación de la cortical ósea. B) La RM
muestra la arquitectura lobular condral y la integridad de la medular. C) Imagen
panorámica de condrosarcoma periostal que muestra una neoplasia cartilaginosa de
patrón lobular asentada sobre la cortical del hueso. Solamente en la base del
tumor se observa osificación encondral reactiva, no neoplásica (x5, HE).
El pronóstico del condrosarcoma yuxtacortical es mucho mejor que el del condrosarcoma primario central y tambien que el del osteosarcoma periostal (1,13).
Condrosarcoma central secundario. Los condrosarcomas secundarios son morfológicamente similares al condrosarcoma convencional por lo que no se pueden distinguir sin los datos radiológicos y clínicos necesarios. Los condrosarcomas secundarios se distinguen por su desarrollo asociado a condiciones predisponentes, identificables clínica y radiológicamente y en ciertos casos histológicamente. Son lesiones predisponentes para el desarrollo de un condrosarcoma central secundario la enfermedad de Paget (14,15), las lesiones por radiaciones (16) y la encondromatosis múltiple (fig. 1), (17) con o sin enfermedad de Ollier (18) o de Maffucci (19). Parece extraordinariamente raro el desarrollo de un condrosarcoma secundario sobre un encondroma probadamente benigno. La mayoría de los autores expertos están de acuerdo que es muy difícil o casi imposible documentar histológicamente la transformación maligna de un encondroma solitario. En revisiones retrospectivas de los cortes histológicos originales se comprobó en muchos casos que se había diagnosticado erróneamente un encondroma cuando realmente se trataba desde un principio de un condrosarcoma de bajo grado. Por otra parte, la transformación condrosarcomatosa en uno o, más raramente, en más huesos de un encondroma es una complicación frecuente en la encondromatosis múltiple (17) con o sin enfermedad de Ollier (18) o síndrome de Maffucci (19). La frecuencia de dicha transformación sarcomatosa ha sido referida en la literatura entre el 20% y el 50%. En las encondromatosis los encondromas muestran hipercelularidad y cierta atipia nuclear, siendo extremadamente difícil el diagnóstico diferencial entre encondroma y condrosarcoma grado 1, por lo que es necesario que el diagnostico se vea apoyado por la clínica y radiología.
Condrosarcoma periférico secundario. Se desarrollan muy infrecuentemente sobre la caperuza de cartílago de un osteocondroma solitario (1%) y más comúnmente de uno o más osteocondromas en pacientes con osteocondromatosis múltiple (10%). Estos datos son bastante especulativos debido a que muchos adolescentes no son seguidos en la edad adulta y la mayoría de las estadísticas provienen de centros especializados de referencia. Las radiologías simples muestran una mineralización irregular y aumento del espesor de la caperuza de cartílago, que es mejor evaluado mediante las técnicas del TAC y de la RM. Los condrosarcomas secundarios a osteocondromas muestran una caperuza de cartílago lobulada y gruesa de más de 2 cm y frecuentemente cavidades quísticas. Generalmente se trata de condrosarcomas de bajo grado. Histológicamente el diagnóstico se basa en que exista una celularidad superior a la que se encuentra en un osteocondroma, presencia de células binucleadas y de células de núcleos bizarros, siendo un hecho definitivo para el diagnóstico la invasión de tejidos adyacentes (20) (fig. 6). Ver addendum.
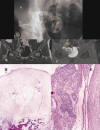
Fig. 6: Condrosarcoma
periférico secundario a osteocondroma. A) RX localizada en región sacroiliaca
derecha; B) RM, corte coronal en secuencia potenciada en T1 y C, RM coronal en
secuencia T2 con supresión de la grasa: Tumoración condral originada en el hueso
iliaco derecho por un pedículo ancho, que crece hacia el interior de la pelvis y
comprime la vejiga. La RM pone de manifiesto el grosor del capuchón
cartilaginoso (flechas negras). D) Microfotografía panorámica que muestra el
gran grosor del casquete condral de una neoformación osteocondromatosa
indicativa de la transformación maligna de la lesión (x5, HE). E)
Microfotografía en que se aprecia invasión por la neoplasia de tejidos blandos
adyacentes (x50, HE).
Condrosarcoma de células claras. Ha sido definido como un raro condrosarcoma de bajo grado que se localiza preferentemente en los extremos epifisarios de los huesos tubulares largos y que se caracteriza histológicamente por células blandas, de citoplasma claro, junto a cartílago hialino. Constituyen aproximadamente el 2% de los condrosarcomas y es más frecuente en varones (3:1). Aunque este tumor ha sido descrito en casi todos los huesos del esqueleto, inclusive en cráneo y huesos de manos y pies, se desarrolla en aproximadamente dos tercios de los casos en los extremos proximales del húmero y fémur (21,22).
Radiológicamente se presenta comúnmente como una lesión osteolítica bien definida, mostrando ocasionalmente un borde escleroso y calcificaciones moteadas. En los tumores de gran tamaño la cortical puede aparecer destruida y existir extensión a los tejidos blandos.
El tamaño del tumor oscila entre 2 y 13 cm y macroscópicamente muestra un tejido blando pero de textura arenosa que puede contener áreas quísticas. Histológicamente el tumor muestra un patrón lobular en visión panorámica. Las células neoplásicas tienen característicamente un citoplasma claro y membranas citoplásmicas bien definidas (fig. 7). Algunas células pueden mostrar un citoplasma rosado asemejándose a las células del condroblastoma. Ambos tipos de células son inmunohistoquímicamente intensamente positivas para la proteína S100. Las mitosis son muy infrecuentes (22).

Fig. 7: Condrosarcoma
de células claras. A) Rx simple: AP de cadera derecha. Se observa lesión lítica
localizada en la cabeza y el cuello femoral con fractura patológica. B) Visión
panorámica microscópica del tumor en la que se reconoce ya a este pequeño
aumento la abundancia de células de citoplasma claro (x15, HE). C) Detalle que
muestra focos de cartílago hialino del tumor rodeados por células neoplásicas de
citoplasma claro. D) Trabéculas de osteoide rodeadas por células neoplásicas de
citoplasma claro. En C) y D) también se encuentran células gigantes de tipo
osteoclástico (x90, HE).
La característica ultraestructural más relevante y constante es la presencia en el citoplasma de grandes cantidades de glucógeno, presentes como partículas aisladas o formando grandes lagos. Además también contienen vacuolas de grasa (23). En el condrosarcoma de células claras pueden encontrarse áreas de condrosarcoma convencional de bajo grado. Se acepta que las áreas de condrosarcoma convencional supongan menos del 50% del tumor para poder realizar el diagnóstico de condrosarcoma de células claras. El cartílago de dichas áreas puede estar calcificado u osificado. También se pueden encontrar, en proporciones variables, depósito de osteoide por las células del estroma y formación de trabéculas óseas inmaduras («woven bone»), entremezcladas con células gigantes de tipo osteoclástico. Frecuentemente se encuentran cambios de quiste óseo aneurismático (21,22).
El diagnóstico diferencial hay que establecerlo radiológicamente con el condroblastoma y el tumor de células gigantes, por tener ambos tumores también localización epifisaria y una imagen radiolúcida, e histológicamente con el condroblastoma fundamentalmente, pero en ocasiones también con el condrosarcoma convencional y el osteoblastoma, por los aspectos histológicos referidos del condrosarcoma de células claras que pueden dar lugar a confusión con estos tumores.
El condrosarcoma de células claras es un tumor agresivo localmente que si es tratado con un curetaje o una extirpación incompleta se produce en la mayoría de los casos recidiva y eventualmente metástasis en pulmones y en otros lugares del esqueleto, siendo la mortalidad en el conjunto de estos casos del 15% (22). Se han descrito tres casos de desdiferenciación en condrosarcomas de células claras (24).
Condrosarcoma desdiferenciado. Es una variante de condrosarcoma que contiene dos componentes claramente definidos: uno correspondiente a un tumor cartilaginoso bien diferenciado (condrosarcoma de bajo grado o condroma) yuxtapuesto a un sarcoma de alto grado no cartilaginoso. Entre ambos componentes existe una transición abrupta (fig. 8). El fenómeno de la desdiferenciación supone un cambio rápido en el comportamiento biológico de un tumor de lenta evolución, poco agresivo localmente y sin capacidad metastásica, a un tumor muy agresivo clínicamente productor de metástasis. Su pronóstico es muy malo, falleciendo el 90% de los pacientes en dos años a pesar de una terapéutica agresiva.
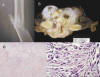
Fig. 8: Condrosarcoma
desdiferenciado. A) Rx simple localizada del fémur: Se observa fractura
patológica sobre una lesión lítica con permeación de la cortical y con
calcificaciones grumosas de tipo condral. B) Pieza quirúrgica de condrosarcoma
desdiferenciado de costilla. Junto a áreas en que el tumor presenta el
característico aspecto hialino, de un condrosarcoma bien diferenciado, se
observan zonas de color pardo o amarillento correspondientes a las áreas del
componente desdiferenciado. C) Visión microscópica panorámica que muestra ambos
componentes de condrosarcoma: Bien diferenciado, en la parte superior de la
imagen, y del componente desdiferenciado en la inferior. Obsérvese la transición
brusca entre ambos componentes (x10, HE). D) Detalle del componente
desdiferenciado que presenta gran atipia celular y mitosis atípicas (x100, HE).
Estos tumores constituyen el 10% de todos los condrosarcomas, afectan a pacientes de más edad que los condrosarcomas convencionales (promedio 50-60 años) y se localizan predominantemente en pelvis, fémur y húmero. Clínicamente debutan por dolor e hinchazón local, siendo también frecuentes la aparición de parestesias y de una fractura patológica. Cuando se detecte un área lítica mal definida y desaparición de las densidades anulares en un encondroma hay que sospechar su transformación maligna.
Macroscópicamente ambos componentes del tumor son evidentes (fig. 8). El componente condral se encuentra generalmente en el centro del tumor que aparece rodeado por tejido tumoral carnoso o hemorrágico que destruye el hueso preexistente y frecuentemente invade los tejidos blandos. Histológicamente el componente sarcomatoso de alto grado muestra las características de un fibrohistiocitoma maligno, aunque también se han observado osteosarcoma, fibrosarcoma y más rara vez rabdomiosarcoma (25-27).
Condrosarcoma sinovial. Tumor extremadamente raro que puede desarrollarse en la cápsula articular «de novo» (condrosarcoma sinovial primario), la forma más rara, o bien producirse secundariamente sobre una condromatosis sinovial preexistente. La mayoría de los casos publicados afectan a las grandes articulaciones de las extremidades inferiores, la más frecuente la rodilla (fig. 9), seguida por el tobillo y la cadera, pero también se han referido casos excepcionales en articulaciones más pequeñas del esqueleto acral.
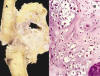
Fig. 9: A)
Pieza quirúrgica de pierna amputada con condrosarcoma sinovial. Gran tumor de
características condrales, extraóseo, que se origina en la sinovial de la
articulación de la rodilla. B) Histológicamente corresponde a un condrosarcoma
grado 2 (x70, HE).
Se debe sospechar un condrosarcoma sinovial si se observa radiológicamente una masa consolidada calcificada en el área articular. Macroscópicamente el tumor consiste en una masa cartilaginosa que característicamente afecta el hueso adyacente. Histológicamente se trata de condrosarcomas de bajo grado histológico (fig. 9) y cómo la condromatosis sinovial puede presentar cierta atipia celular el diagnóstico diferencial entre benignidad y malignidad puede ser difícil. Se ha considerado que la pérdida del patrón de agrupamiento celular, los cambios mixoides prominentes y uniformes, la morfología fusiforme en la periferia de los lóbulos tumorales y la necrosis deben levantar la sospecha de condrosarcoma. Es mandatorio que el diagnóstico de condrosarcoma se base en el análisis de evidencia clínica, radiológica e histológica pero es frecuente que el diagnóstico de condrosarcoma sinovial se establezca tras varias recidivas locales de lesiones diagnosticadas de condromatosis sinovial. Aproximadamente el 50% de los casos publicados de condrosarcoma sinovial desarrollaron metástasis pulmonares, la mayoría en los tres años tras el diagnóstico. El condrosarcoma sinovial ha de ser tratado con una cirugía agresiva radical (28,29).
Condrosarcoma laríngeo. El condrosarcoma laringeo es un tumor raro pero es el tumor maligno no epitelial de la laringe más frecuente, comprendiendo el 75% de los sarcomas laríngeos. Ferlito y col., referido por Meyer-Breiting y Burkhart, recogieron en 1984, 149 casos de la literatura y añadieron tres casos propios (30). Nosotros hemos visto un solo caso entre 1977 y 2005 entre más de mil pacientes con tumores malignos de laringe. El lugar más frecuente de aparición del condrosarcoma laríngeo es la porción dorsal del cartílago cricoides. Desde allí el tumor puede extenderse hasta el esófago y en ciertos casos ocasionar disfagia antes que disnea. En segundo lugar se originan en el cartílago tiroides y son rarísimos en la epiglotis. Se ven más afectados los varones y las personas de edad avanzada. Los tumores generalmente tienen un crecimiento lento. Las características radiológicas son relativamente típicas exhibiendo el tumor nódulos de densidad variable con focos de calcificación. Macroscópicamente nódulos tumorales de consistencia dura empujan la mucosa intacta hacia la luz de la laringe. Histológicamente predominan los tumores de bajo grado (1,2). Se han referido raros casos de transformación maligna de condromas laríngeos, posiblemente muy cuestionables ya que el diagnóstico diferencial entre benignidad y malignidad puede ser harto difícil. Los condrosarcomas de bajo grado tienden a recidivar pero sólo excepcionalmente metastatizan en tanto que en los escasísimos tumores de alto grado se producen metástasis hematógenas a distancia, más frecuentemente en pulmón (30,31).
Condrosarcoma mesenquimal. Es un tumor maligno raro caracterizado por un patrón bimórfico con un componente de células pequeñas redondas altamente indiferenciadas y otro componente de islotes de cartílago hialino bien diferenciado. Es una neoplasia relativamente infrecuente que en aproximadamente un tercio de los casos aparece en los tejidos blandos (32,33). También se ha referido en meninges, órbita y en localizaciones sorprendentes como la válvula mitral (34-36). En el esqueleto se origina con frecuencia decreciente en los huesos tubulares largos, especialmente en el fémur, huesos craneofaciales, especialmente en los maxilares, del cinturón pélvico, costillas y vértebras, habiéndose referido también casos de condrosarcomas mesenquimales múltiples (32,33).
Las características radiológicas generalmente no difieren significativamente de las del condrosarcoma convencional. En principio son líticas, de bordes mal definidos y muestran a veces calcificaciones moteadas. Frecuentemente el hueso aparece expandido y es frecuente que se observe rotura del córtex e invasión de partes blandas. Los tumores extraesqueléticos no tienen características específicas y muestran cacificaciones de tipo condral y focos con señal de baja intensidad dentro de lóbulos de señal aumentada (fig. 10) (32,33).

Fig. 10: Condrosarcoma
mesenquimal extraesquelético en varón de 37 años A) Rx lateral de muslo; B) y C)
CT de muslo. Masa de partes blandas con calcificaciones en anillo y puntiformes,
situada en el compartimento posterior del muslo, separada del fémur. D)
Condrosarcoma mesenquimal humeral en mujer joven de 24 años. Rx simple, AP de
húmero. Extensa lesión lítica permeativa, de localización metáfiso-diafisaria
con fractura patológica.
Macroscópicamente, tienen color gris blanquecino a gris rosado y su consistencia es dura con áreas blandas. La mayoría de estos tumores contienen depósitos duros mineralizados que pueden aparecer como focos dispersos o constituir amplias zonas. Histológicamente el condrosarcoma mesenquimal se caracteriza por una proliferación de pequeñas células indiferenciadas, redondeadas, fusiformes o poligonales, dispuestas de forma apretada, que frecuentemente presentan un patrón hemangiopericitoide. En el seno de campos de dichas células indiferenciadas se encuentran islotes de tejido condral bien diferenciado que pueden ser equivalentes al cartílago de un encondroma o de un condrosarcoma convencional de bajo grado (fig. 11). La cantidad de cartílago es muy variable, pudiendo ser muy escaso el componente condral, por lo que en ocasiones ha de realizarse un amplio muestreo para poder realizar el diagnóstico. También pueden hallarse en estos tumores células gigantes multinucleadas ocasionales, osteoide e incluso osificación endocondral con formación de hueso con médula ósea. Algunos autores han referido que es importante distinguir entre aquellos tumores con células fusiformes y patrón hemangiopericitoide de aquellos que muestran sábanas de células redondeadas («Ewing-like»), ya que estas diferencias tienen importancia pronóstica y terapéutica: los tumores con patrón Ewing-like responderían mejor a la quimioterapia (2).
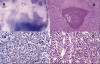
Fig. 11: Condrosarcoma
mesenquimal. A) visión microscópica panorámica que muestra ambos componentes
histológicos: De condrosarcoma bien diferenciado (áreas claras) y de sarcoma
indiferenciado (áreas oscuras) (x5, HE). En B) se observan tambien ambos
componentes. El bien diferenciado (centro) aparece calcificado en su porción
central (x15, HE). C) Componente de sarcoma indiferenciado consistente en
células redondas pequeñas y D) patrón peri-vascular hemangiopericitoide del
componente indiferenciado (x95, HE).
El diagnóstico histológico no tiene problemas si en la biopsia existen ambos componentes pero si no está presente el componente cartilaginoso el diagnóstico puede ser muy difícil. Habrán de ser considerados todos los tumores malignos de células redondas que ocurren en el hueso. Con la ayuda de la inmunohistoquimia se pueden descartar los linfomas, metástasis de rabdomiosarcoma embrionario y osteosarcoma pero al ser las células positivas para vimentina, Leu7 y CD99 la diferenciación con el sarcoma de Ewing se hace difícil. Únicamente el marcador citogenético para el cariotipo t(11;22)(q24;q12) que es específico para el sarcoma de Ewing y tumores primitivos neuroectodérmicos y que no se ha visto en el condrosarcoma mesenquimal puede proporcionar en diagnóstico. Esta anormalidad cromosómica se describió en el condrosarcoma mesenquimal (38) y osteosarcoma de células pequeñas (39) pero estudios posteriores no han confirmado estos hallazgos (32,40).
El condrosarcoma mesenquimal es una neoplasia muy maligna. Son frecuentes las recidivas y metástasis a distancia, las cuales pueden producirse después de 20 años. Los tumores mandibulares parece que tienen un curso más indolente que en otras localizaciones (32). Se ha referido osteomalacia oncogénica secundaria al condrosarcoma mesenquimal (41).
Condrosarcoma mixoide extraesquelético. Tumor maligno de los tejidos blandos caracterizado por una arquitectura multinodular, abundante matriz mixoide y células malignas de aspecto condroblastoide («chondroblastic-like») dispuestas formando cordones, nidos o una delicada red. A pesar del nombre no se ha demostrado una evidencia convincente de diferenciación cartilaginosa. Este tumor ocurre exclusivamente en los tejidos blandos. Los condrosarcomas óseos con extensos cambios mixoides son tumores realmente condrales y tienen características biológicas, inmunohistoquímicas y fundamentalmente citogenéticas distintas. Se localizan preferentemente en los planos profundos de las porciones proximales de las extremidades y cinturones escapulohumeral y pélvico, especialmente en la cadera. También ocurren con mucha menor frecuencia en el tronco, región paraespinal, cabeza y cuello y pies. Se han referido casos raros en los dedos, retroperitoneo, pleura, intracraneales (42) y en hueso (42-46). Aunque aparecen a cualquier edad su máxima incidencia es en la quinta y sexta décadas.
Los tumores son de gran tamaño y aparecen bien delimitados por una seudocápsula. La superficie de corte muestra nódulos de consistencia gelatinosa separados por septos fibrosos y pueden presentar áreas quísticas, hemorrágicas y de necrosis recientes y no recientes. Los tumores muy celulares tienen una consistencia carnosa. Histológicamente (fig. 12) muestran un patrón lobular. Están constituidos por células poligonales o fusiformes que forman hileras, trabéculas o pequeños nidos y se hallan inmersas en una matriz mixoide, rica en mucopolisacáridos sulfatados (condroitín sulfato) formando una fina malla o enrejado cribiforme. Los núcleos celulares son redondeados u ovales con una fina cromatina distribuida uniformemente y presentan un pequeño nucleolo. En algunos tumores se pueden tambien encontrar células de aspecto epitelioide de citoplasma eosinófilo abundante que tienen un núcleo vesiculoso y un nucleolo grande, así como también células de tipo rabdoide que contienen glóbulos citoplásmicos hialinizados. Los lóbulos tumorales generalmente son más celulares en las zonas periféricas. Focos de cartílago hialino bien formado realmente no se encuentran. Las mitosis son muy poco abundantes (2/10cga). El aspecto histológico del condrosarcoma mixoide extraesquelético recuerda al del cordoma por lo cual ha sido denominado sarcoma cordoide y en su diagnóstico diferencial hay que considerar el paracordoma. El material mucinoso extracelular consiste en condroitín 4 sulfato, condroitín 6 sulfato y keratán sulfato, que se tiñe intensamente con el hierro coloidal y el azul de alcián. Estas tinciones no son inhibidas cuando los cortes son pretratados con hialuronidasa, inhibición que sucede con otros sarcomas mixoides y el paracordoma, lo cual sirve para el diagnóstico diferencial.
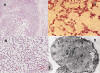
Fig. 12: Condrosarcoma
mixoide extraesquelético. A) Visión microscópica panorámica que muestra el
patrón lobular del tumor. El lóbulo tumoral aparece rodeado por una banda de
tejido conectivo (x10, HE). B) y C) El tumor aparece constituido por células
alargadas que forman finos cordones anastomosados que circunscriben espacios que
aparecen ocupados por un material mixoide (B, x20; c, x100; HE). D) Imagen
ultraestructural de un corte transversal de los túbulos paralelos, presentes en
el RER, de 25 nm de diámetro que muestran un patrón geométrico hexagonal
(x34100).
Ultraestructuralmente las células tumorales son poligonales o estrelladas, a veces fusiformes y presentan proyecciones citoplásmicas irregulares. Frecuentemente se hallan dispuestas formando cordones, presentando una buena cohesión celular y a veces uniones primitivas. El citoplasma es rico en organelas y contiene cantidades variables de glucógeno y filamentos intermedios (43). Un hallazgo bastante frecuente es la presencia en el RER de túbulos paralelos de 25 nm de diámetro que en cortes transversales tienen un patrón geométrico hexagonal. Dichas estructuras que no se han observado en células de los diferentes estadíos del desarrollo del cartílago normal se han observado sin embargo en otros tumores (23).
Inmunohistoquímicamente la vimentina es el único marcador expresado por las células tumorales. La proteína S100, citoqueratinas y EMA son expresados en una minoría de tumores y en algunos se ha encontrado expresión de NSE o de sinaptofisina. Citogenéticamente, en aproximadamente la mitad de los casos estudiados se ha observado la translocación recíproca t(9;22)(q22;q15) y la translocación específica menos común t(9;17)(q22;q11) en un segundo subgrupo citogenético de tumores.
En el diagnóstico diferencial de este tumor hay que considerar los tumores malignos de características mixoides de partes blandas, sarcomas y los tumores mixtos malignos de origen en glándulas salivares y de origen en glándulas sudoríparas. Especial interés tiene el diagnóstico diferencial con el raro paracordoma ya que este tumor tiene usualmente un comportamiento clínico benigno.
El condrosarcoma mixoide extraesquelético tiene una supervivencia larga pero con alto índice de recidivas y metástasis, en aproximadamente la mitad de los casos así como un elevado índice de muerte asociada a enfermedad. No obstante no es infrecuente una supervivencia larga en casos de enfermedad metastásica (42).
BIBLIOGRAFÍA
Bertoni F, Bacchini, Hogendoorn PCW. Chondrosarcoma. En: Tumours of Soft Tissue and Bone. Pathology and Genetics. Fletcher CDM, Unni KK, Mertens F, editores. World Health Organization Classification of Tumours. Lyon: IARCPress; 2002. p. 247-51.
Dorfman HD, Czerniak B. Malignant cartilage tumors. En: Bone Tumors. St. Louis: Mosby; 1998. p. 353-439.
Unni KK. Dahlin´s Bone Tumors. Chondrosarcoma. En General Aspects and Data on 11087 Cases. 5ª ed. Philadelphia: Lipincott-Raven; 1996. p. 71-108.
Evans HL, Ayala A, Romsdahl MM. Prognostic factors in chondrosarcoma of bone: a clinicopathologic analysis with emphasis in histologic grading. Cancer 1977; 40: 818-31.
Schajovicz F. Cartilage forming tumors. In Tumors and Tumor-like Lesions of Bone. Berlin: Springer; 1994. p. 160-204.
Hernández González Y, Salamanca J, Resines Erasun C, Martínez-Tello FJ. Non- monomelic synchronus primary multicentric chondrosarcoma: A case report. Acta Orthop Belg 2005; 71: 242-8.
Mirra JM, Gold R, Downs J, Eckardt JJ. A new histological approach to the differentiation of enchondroma from chondrosarcoma of bone. A clinicopathologic analysis of 51 cases. Clin Orthop 1985; 201: 214-37.
Dahlin DC, Salvador AH. Chondrosarcoma of bones of the hands and feet. A study of 30 cases. Cancer 1974; 34: 755-60.
Huvos AG. Condrosarcoma of the facial bones. En: Huvos AG, editor. Bone Tumors, 2ª ed. Philadelphia: W.B. Saunders Company; 1991. p. 395-401.
Huvos AG. Chondrosarcoma in the young. En: Huvos AG, editor. Bone Tumors, 2ª ed. Philadelphia: W.B. Saunders Company; 1991. p. 347-348.
Schajowicz F. Juxtacortical chondrosarcoma. J Bone Joint Surg 1977; 59B: 473-80.
Nojima T, Unni KK, Mc Leod RA, Pritchard DJ. Periosteal chondroma and periosteal chondrosarcoma. Am J Surg Patol 1985; 9: 666-77.
Bertoni F, Boriani S, Laus N, Campanacci M. Periosteal chondrosarcoma and periosteal osteosarcoma: two distinct entities. J Bone Joint Surg 1982; 64B: 370-76.
Haibach H, Farrell C, Dittrich FJ. Neoplasms arising in Paget´s disease of bone: a study of 82 cases. J Clin Pathol 1985; 83: 594-600.
Hadjipvlou A, Lander P, Srolovitz H, Enker IP. Malignant transformation in Paget´s disease of bone. Cancer 1992; 70: 2802-8.
Weatherby RP, Dahlin DC, Ivins JC. Post-radiation sarcoma of bone. Mayo Clin Proc 1981; 56: 294-306.
Schwartz HS, Zimmerman NB, Simion MA, Wroble RR, Millar EA, Bonfiglio M. The malignant potential of enchondromatosis. J Bone Joint Surg 1987; 69A: 269-74.
Liu J, Hudkins PG, Swee RG, Unni KK. Bone sarcoma associated with Ollier´s disease. Cancer 1987; 59: 1376-85.
Sun TC, Swee RG, Shives TC, Unni KK. Chondrosarcoma in Maffucci´s syndrome. J Bone Joint Surg 1985; 67A: 1214-9.
Garrison RC, Unni KK, Mc Leod RA, Pritchard DJ, Dahlin DC. Chondrosarcoma arising in osteochondroma. Cancer 1982; 49: 1890-97.
Bjornsson J, Unni KK, Dahlin DC, Beabout JW, Sim HH. Clear cell chondrosarcoma of bone. Observations in 47 cases. Am J Surg Pathol 1984; 8: 223-30.
Mc Carthy EF, Freemont A, Hogendoorn PCW. Clear cell chondrosarcoma. En: Fletcher CDM, Unni KK, Mertens F, editores. Tumours of Soft Tissue and Bone. Pathology and Genetics. World Health Organization Classification of Tumours. Lyon: IARCPress; 2002. p. 257- 8.
Martínez-Tello FJ, Martínez-González. MA. The ultrastructure of cartilaginous tumors. En: Bonucci E, Motta PM, editores. Ultrastructure of skeletal tissues. Bone and Cartilage Diseases in Health and Disease. Boston: Kluwer Academic Publishers. 1990; p. 189-207.
Kalil RK, Inwards CY, Unni KK, Bertoni F, Bachini P, Wenger DE, Sim FH. Dedifferentiated clear cell chondrosarcoma. Am J Surg Pathol 2000; 24: 1079-86.
Dahlin DC, Beabout JW. Dedifferentiation of low-grade chondrosarcomas. Cancer 1971; 28: 461-6.
Tetu B, Ordoñez NG, Ayala AG, Mac Kay B. Chondrosarcoma with additional mesenchymal component (dedifferentiated chondrosarcoma). II. An immunohistochemical and electromicroscopic study. Cancer 1986; 58: 287-98.
Milchgrub S, Hogendoorn PCW. Dedifferentiated chondrosarcoma. . En: Fletcher CDM, Unni KK, Mertens F, editores. Tumours of Soft Tissue and Bone. Pathology and Genetics. World Health Organization Classification of Tumours. Lyon: IARCPress; 2002. p. 252-4.
Bertoni F, Unni KK, Beabout JW, Sim FH. Chondrosarcomas of the synovium. Cancer 1991; 67: 155-62.
Davis RI, Hamilton A, Biggart JD. Primary synovial chondromatosis: a clinico-pathologic review and assessment of malignant potential. Hum Pathol 1998; 29: 683-8.
Meyer-Breiting E, Burkhart A. Unusual, malignant tumours. Chondrosarcoma. En: Burkhardt A, Meyer-Breiting E, editores. Tumours of the larynx. Histopathology and clinical inferences. Berlin: Springer; 1998. p. 157-8.
Ruark DS, Schleheider UK, Shah JP. Chondrosarcomas of the head and neck. World J Surg 1992; 16: 1010-6.
Nakashima Y, Park YK, Sugano O. Mesenchymal chondrosarcoma. En: Fletcher CDM, Unni KK, Mertens F, editores. Tumours of Soft Tissue and Bone. Pathology and Genetics. World Health Organization Classification of Tumours. Lyon: IARCPress; 2002. p. 255-6.
Nakashima Y, Unni KK, Shives TC, Swee RG, Dahlin DC. Mesenchymal chondrosarcoma of bone and soft tissues: a review of 111 cases. Cancer 1986; 57: 2444-53.
Rollo JL, Green WR, Kahn LB. Primary meningeal mesenchymal chondrosarcoma. Arch Pathol Lab Med 1979; 103: 239-43.
Reeh MJ. Hemangiopericytoma with cartilaginous differentiation involving orbit. Arch Ophtalmol 1966; 75: 82-3.
Muir CS, Seah CS. Primary chondrosarcoma of the mitral valve. Thorax 1966; 21: 254-62.
Shapeero LG, Vanel D, Couanet D, Contesso G, Ackerman LW. Extra skeletal mesenchymal chondrosarcoma. Radiology 1993; 186: 819-26.
Sainati L, Scapinello A, Montaldi A, Boleato S, NinfoV y col. A mesenchymal chondrosarcoma of a child with the reciprocal translocation t(11;22)(q24;q12) . Cancer Genet Cytogenet 1993; 71:144-7.
Noguera R, Navarro S, Triche TJ. Translocation (11; 22) in small cell osteosarcoma. Cancer Genet Cytogenet 1990; 45: 121-4.
Kalil R, Bridge JA. Small cell osteosarcoma. En: Fletcher CDM, Unni KK, Mertens F, editores. Tumours of Soft Tissue and Bone. Pathology and Genetics. World Health Organization Classification of Tumours. Lyon: IARCPress; 2002. p.274.
Zura RD, Minasi JS, Kahler DM. Tumor-induced osteomalacia and symptomatic looser zones secondary to mesenchymal chondrosarcoma. J Surg Oncol 1999; 71: 58-62.
Lucas DR, Heim S. Extra skeletal myxoid chondrosarcoma. En: Fletcher CDM, Unni KK, Mertens F, editores. Tumours of Soft Tissue and Bone. Pathology and Genetics. World Health Organization Classification of Tumours. Lyon: IARCPress; 2002. p. 213-5.
Kilpatrick SE, Inwards CY, Fletcher CD, Smith MA, Gitelis S. Myxoid chondrosarcoma (chordoid sarcoma of bone; a report of two cases and review of the literature. Cancer 1997; 79: 1903-10.
Martínez-Tello FJ, Navas –Palacios JJ. Ultrastructural study of conventional chondrosarcomas and Myxoid- and mesenchymal chondrosarcomas. Virchows Arch (Pathol Anat) 1982; 396: 197-211.
Huvos AG. Myxoid chondrosarcoma. En: Huvos AG, editor. Bone Tumors, 2ª ed. Philadelphia: W.B. Saunders Company; 1991. p. 366-367.
Weiss SW, Goldblum JR.Chapter34. Cartilaginous soft tissue tumors. Extraskeletal myxoid chondrosarcoma. En: Weiss SH, Goldblum JR, editores Enzinger and Weiss´s Soft Tissue Tumors. St Louis: Mosby; 2001; p. 1368-79.
Addendum: En casos en que la distinción entre osteocondroma y condrosarcoma periférico es difícil, Bcl-2 es un marcador diagnóstico de malignidad valioso (Hameetman L, Kok P, Eilers PH, Cletan-Jansen AM, Hogendoorn PC, Bove JV. The use of Bcl-2 and PTHLH inmunohistochemistry in the diagnosis of peripheral chondrosarcoma in a clinicopathological setting. Virchows Arch 2005, 446: 430-7).