
Vol. 38, n.º 1, 2005
REVISTA
ESPAÑOLA DE
Vol. 38, n.º 1, 2005 |
CASUÍSTICA
Eduardo Solís-García, Jesús
Sánchez-Sánchez-Vizcaíno1, Beatriz Rodríguez-Enríquez2,
Juan José Segura-Sánchez, Antonio Robles-Frías
Servicio de Anatomía Patológica. Hospital Infanta Margarita. Cabra (Córdoba).
1 Servicio de Dermatología.
2 Servicio de Cuidados Críticos y Urgencias.
eduardo.solis.sspa@juntadeandalucia.es
RESUMEN
Hidradenoma túbulo-papilar (HPT) es el término propuesto para designar tumores ductales dérmicos con diferenciación divergente ecrina y apocrina, englobando un espectro de lesiones que incluye adenoma tubular apocrino (ATA) y adenoma ecrino papilar (AEP).
Presentamos un caso de HPT localizado en la pierna de una mujer de 81 años de edad. El perfil inmunohistoquímico demostró la coexistencia de inmunofenotipos secretores apocrino y ecrino.
Palabras clave: glándulas sudoríparas, adenoma tubular apocrino, adenoma tubular papilar, glándulas apoecrinas.
SUMMARY
Tubulopapillary hidradenoma (TPH) is a term describing dermal ductal tumors with both eccrine and apocrine differentiation, encompassing a spectrum of lesions including tubular apocrine adenoma and papillary eccrine adenoma. We report a case of a TPH in a 81-years-old woman located on the leg. The immunohistochemical profile revealed the coexistence of eccrine and apocrine secretory immunophenotypes.
Key words: sweat glands, tubular apocrine adenoma, papillary tubular adenoma, apocrine, eccrine.
INTRODUCCIÓN
HPT es un término controvertido que hace alusión a un espectro de tumores anexiales cutáneos que engloba tanto al ATA como al AEP, indicando la diferenciación híbrida ecrina y apocrina de muchos de ellos, que dificulta sobremanera su diagnóstico histológico.
El caso que presentamos mostraba hallazgos histológicos de diferenciación anexial intermedia, constatados no sólo por el patrón túbulo-papilar del mismo con ocasionales dilataciones quísticas tubulares y secreción por decapitación de las células luminales, sino también por el inmunofenotipo divergente de las dos capas de células epiteliales que revestían dichas estructuras tubulares.
Discutiremos los posibles mecanismos operantes en la patogénesis de esta curiosa tumoración, así como, la supuesta relación con las glándulas apoecrinas descritas por Sato y cols. a nivel axilar.
DESCRIPCIÓN DEL CASO
Mujer de 81 años de edad que acude a la consulta de Dermatología por la existencia de una tumoración excrecente localizada en pierna derecha, de un año de evolución. La tumoración referida era dura al tacto, nodular y polilobulada, con superficie lisa y coloración rosada. No estaba ulcerada. Con el diagnóstico clínico de histiocitoma o merkeloma, se extirpa y se remite al servicio de Anatomía Patológica.
Macroscópicamente el fragmento de piel medía 2,7 cms. de dimensión máxima y presentaba en localización central una lesión nodular, sobreelevada y sesil de 1,4 cms., constituida al corte por un tejido tumoral blanquecino de consistencia elástica.
Histológicamente la tumoración estaba constituida por una proliferación intradérmica de túbulos revestidos por una doble capa de células epiteliales, cilíndricas las luminales y cuboideas las de la capa externa (figs. 1 y 2). Los núcleos de las mismas eran isomorfos, sin atipia y ocasionalmente tenían alguna mitosis. Muchos de estos túbulos mostraban crecimientos papilares intraluminales de las células de la capa interna (fig. 3), así como secreción por decapitación de los bordes citoplasmáticos adluminales de las mismas (fig. 4). La tumoración tenía márgenes no infiltrantes y dejaba una zona «grenz» subepidérmica respetada (fig. 1). Destacaba la presencia de dilataciones quísticas tubulares en la periferia tumoral (fig. 2).
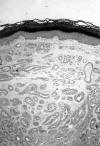
Fig. 1: La
tumoración está constituida por una proliferación intradérmica de túbulos (H-E,
4X).

Fig. 2: Dilataciones
quísticas tubulares en la periferia tumoral (H-E, 4X).

Fig. 3: Crecimientos
papilares intraluminales (H-E, 10X).
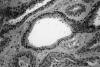
Fig. 4: Secreción
por decapitación de las células adluminales (H-E, 20X).
Se procedió a su estudio inmunohistoquímico revelando inmunorreacción del borde luminal de las células de la capa interna para «proteína del fluido de la enfermedad quística» (GCDFP-15), en algunos túbulos, precisamente los que mostraban secreción por decapitación en sus células luminales (fig. 5). Tanto CEA, como EMA y proteína S-100, teñían el borde luminal y el contenido de los túbulos (figs. 6 y 7). Las células luminales reaccionaban frente a los anticuerpos lisozima y alfa-1-antiquimotripsina, mientras que las células de la capa externa lo hacían frente a Actina de músculo liso (fig .8). Las células epiteliales de ambas capas inmunoexpresaban citokeratinas AE1/AE3.

Fig. 5: Los
bordes apicales de las células de la capa interna y el contenido luminal
inmunorreaccionan frente a GCDFP-15 (10X).

Fig. 6: Borde
luminal de las células inmunoteñido con EMA (10X).

Fig. 7: Tinción
de membrana con CEA (10x).
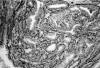
Fig. 8: Las
células de la capa externa inmunorreaccionan frente a Actina de músculo liso
(10X).
DISCUSIÓN
El AEP es un tumor benigno infrecuente de glándulas sudoríparas ecrinas descrito por Rulon y Helwig (1) en 1977. Se le considera la contraparte ecrina del ATA, cuya primera descripción se atribuye a Landry y Winkelmann (2) en 1972. Ambos se presentan como nódulos solitarios cutáneos de características indefinidas, aunque a diferencia del ATA, que generalmente se localiza en cuero cabelludo y en ocasiones asociado con hamartomas de diferenciación apocrina, como el nevus sebáceo de Jadassohn o el siringocistoadenoma papilífero, el AEP suele localizarse en las extremidades de mujeres que, frecuentemente, son de raza negra (3).
Histológicamente ambas neoplasias muestran hallazgos distintivos que permiten definir su diferenciación hacia la estirpe ecrina o apocrina; así, el patrón tubular ramificante, la secreción por decapitación de las células epiteliales que revisten la superficie luminal de dichos túbulos y la conexión de éstos con la superficie epidérmica, característicos del ATA, contrastan con los casos típicos de AEP los cuales suelen evidenciar túbulos con dilatación quística (patrón siringoide) y ausencia de, secreción por decapitación y conexión epidérmica (4).
No obstante, el reconocimiento de casos clínico-patológicos arquetipos de ambas entidades, es la excepción más que la regla, siendo habitual encontrar tumores, que aún conservando su ubicación clínica contrastada, muestran hallazgos histológicos superponibles de ambos, haciendo la distinción entre AEP y ATA imposible y en estas ocasiones, es prudente adoptar una terminología intermedia, originalmente atribuida a Falck y cols.(5), los cuales propusieron la denominación conjunta de HPT o adenoma tubular papilar, sin ningún calificativo alusivo a su diferenciación. Requena y cols (6) afirman que ambas entidades son una sola y, la presencia o ausencia de secreción por decapitación, depende únicamente de la presión en el interior de las estructuras túbulo-quísticas. Cuando hay abundante material de secreción intraluminal, las células parietales pierden, por compresión, su morfología columnar habitual y no se evidencia secreción por decapitación.
El caso que presentamos estaría encuadrado dentro de esta gama de tumores con hallazgos apocrinos y ecrinos, superpuestos; de tal forma que, su patrón histológico era tubular con crecimientos papilares intraluminales, muchos de estos túbulos mostraban dilatación quística, siempre dejaban una zona «grenz» subepidérmica respetada y los túbulos estaban revestidos por una doble capa celular, siendo habitual que la capa luminal mostrara signos de secreción por decapitación.
Incluso desde el punto de vista inmunohistoquímico, compartía hallazgos de uno y otro inmunofenotipo; así, la expresión de alfa-1-antiquimotripsina y lisozima en las células de la capa interna de los túbulos y de GCDFP-15 en el borde apical de las células luminales, son reveladoras de diferenciación apocrina (7,8), mientras que la inmunoexpresión de proteína S-100, CEA y EMA en el borde luminal de las células de la capa interna, es altamente sugestiva de diferenciación ecrina (9).
Esta coexistencia de hallazgos ecrinos y apocrinos, tan sólo podría ser explicada aceptando que estos tumores de patrón híbrido, tuvieran su origen en las glándulas sudoríparas apoecrinas, las cuales fueron descritas por Sato y cols (10) en 1987 mediante estudio histológico de las piezas quirúrgicas de disección axilar realizadas para el tratamiento de la hiperhidrosis. Estos autores se percataron de la existencia de una glándula apocrina provista de un conducto excretor largo que, en lugar de abrirse al infundíbulo folicular, como lo haría una glándula apocrina convencional, aboca directamente a la epidermis de forma análoga al acrosiringio de una glándula ecrina (11).
Las glándulas apoecrinas son por tanto exclusivas de la región axilar y parecen desarrollarse tras la pubertad a partir de glándulas ecrinas preexistentes y bajo la influencia de estímulos hormonales (12).
Aceptando como un hecho el absoluto rechazo de la existencia de glándulas apoecrinas extraxilares, tan sólo sería congruente deducir que bajo estímulos tumorigénicos apropiados, una neoplasia originalmente de diferenciación ecrina, pudiera mostrar hallazgos de diferenciación apocrina y viceversa.
Aunque la naturaleza benigna de estos tumores, histológicamente es evidente ante la ausencia de necrosis, mitosis atípicas, ulceración e invasión vascular o perineural; existen entidades de comportamiento biológico maligno, que pueden compartir hallazgos histológicos con ellos y entre los cuales se incluirían el adenoma papilar digital agresivo, el carcinoma basocelular con diferenciación ecrina y algunos carcinomas ecrinos (13).
BIBLIOGRAFÍA
Rulon DB, Helwig EB. Papillary eccrine adenoma. Arch Dermatol 1977; 113: 596-8.
Landry M, Winkelmann RK. An unusual tubular apocrine adenoma. Arch Dermatol 1972; 105: 869-79.
Mckee PH. Tumors of the epidermal appendages. En: Mckee PH, editor. Pathology of the skin. Londres: Mosby-Wolfe; 1996. p. 15. 1-74.
Tellechea O, Reis JP, Marques C., Poiares Baptista A. Tubular apocrine adenoma with eccrine and apocrine immunophenotypes or papillary tubular adenoma ?. Am J Dermatopathol 1995; 17(5): 499-505.
Falck VG, Jordaan HF. Papillary eccrine adenoma: a tubulopapillary adenoma with eccrine differentiation. Am J Dermatopathol 1986; 8: 64-72.
Requena L, Kiryu H., Ackerman AB. Tubular adenoma. En: Neoplasms with apocrine differentiation. 1.ª ed. Filadelfia: JB Lippincott-Raven; 1998. p.163.
Fox SB., Cotton DWK. Tubular apocrine adenoma and papillary eccrine adenoma: entities or unity?. Am J Dermatopathol 1992; 14: 149-54.
Wollina U, Rulke D, Schaarschmidt H. Dermal cylindroma: expresión of intermediate filaments, epithelial and neuroectodermal antigens. Histol Histopathol 1992; 19: 294-301.
Cotton DWK. Immunohistochemical staining of normal sweat glands. Br J Dermatol 1986; 114: 441-9.
Sato K, Leidal R, Sato F. Morphology and development of an apoeccrine sweat gland in the human axillae. Am J Physiol 1987; 252: 166-80.
Scrivener Y, Cribier B. Morphologie des glandes sudorales. Morphologie 2002; 86 : 5-17.
Kamada A, Saga K, Jimbow K. Apoeccrine sweat duct obstruction as a cause for Fox-Fordyce disease. J Am Acad Dermatol 2003; 48: 453-5.
Jackson EM, Cook J. Mohs micrographic surgery of a papillary eccrine adenoma. Dermatol Surg 2002; 28: 1168-72.