
Vol. 37, n.º 3, 2004
REVISTA
ESPAÑOLA DE
Vol. 37, n.º 3, 2004 |
Marianna Rosasco, Dardo Centurión, Julio Carzoglio
Laboratorio de Anatomía Patológica. Hospital Maciel. Facultad de Medicina. Universidad de la República. Montevideo. Uruguay.
Correspondencia: Dra. Marianna Rosasco,
Laboratorio de Anatomía Patológica, Hospital Maciel, 25 de Mayo, 174, CP 11000,
Montevideo, Uruguay. mrosasco@adinet.com.uy;
dardocenturion@adinet.com.uy;
jcarzogl@adinet.com.uy
RESUMEN
El Carcinoma de mama masculina es el 0.5 al 1 % de los tumores de mama y el 0.17 a 1.5% de los tumores malignos. En Uruguay la tasa de incidencia es de 0.80 (1991).
Se analizan 16 casos de carcinoma de mama masculina. La edad media al diagnóstico fue 64 años. El 87.50% fueron retroareolares. El eje mayor promedio fue 23.6 mm. El tipo histológico ordinario (N.O.S) se observó en el 75% (12), CDI en alguna de sus variantes en el 12.5% (2), CD «in situ» en 12.5% (2). El grado histológico final III se observó en 6 de los casos , el II en 5 casos y el I en 3 casos.
El carcinoma de mama en el hombre en nuestro país, muestra similares características epidemiológicas, clínicas y morfológicas a las comunicadas en la literatura mundial. Presenta un perfil clínico y patológico propio como enfermedad, con edad de presentación 5 a 10 años más tarde que en la mujer y topografía predominantemente retroareolar. El tamaño tumoral aparece como el factor pronóstico más importante, el tipo histológico mas frecuente es el CDI de tipo N.O.S. (70%), con grado histológico II o III en 80% de los casos.
Palabras clave: Cáncer de mama, hombre, carcinoma ductal.
SUMMARY
Male breast cancer ranges from 0.5 to 1% of breast tumors, and 0.17 to 1.5% of malignant tumors. In Uruguay the incidence is 0.80 (1991).
We report 16 cases of male breast carcinoma. The mean age at presentation was 64 years. 84.50% were retroareolar. The mean size was 23.6 mm. The usual type (not otherwise specified) was 75%, variants 12.5%, «in situ» 12.5%. Final score III was assessed in 6 cases, II in 5 cases and I in 3 cases.
Breast male cancer in our country shows similar epidemiology, clinical and morphologic features that those reported in the international literature. It has a characteristic clinical and pathological profile, with diagnostic made 5 to 10 years later than in females and retroareolar localization. The tumor size appears to be the most important prognostic factor; the most frequent histologic type is N.O.S. (70%), histologic grade II or III in 80% of the cases reported.
Key words: Breast cancer, male, ductal carcinoma.
INTRODUCCIÓN
En el hombre la mama es un órgano rudimentario, donde el desarrollo del cáncer es poco frecuente. Entre el 0,5 y 1% de todos los canceres de mama se desarrollan en el hombre y corresponde al 0,17 a 1,5% de todos los tumores malignos en pacientes de sexo masculino (1-11).
Se estima que en EE.UU., 1.000 nuevos casos y 300 muertes ocurren por año, representando estas cifras, el 0,5% y 0,7% de morbilidad y mortalidad por cáncer de mama, respectivamente (2-3).
En nuestro país, el Registro Nacional del Cáncer reporta una tasa de incidencia ajustada por edad para el año 1991 de 0,80 (12).
Si bien el cáncer de mama en el hombre es similar al cáncer de mama en la mujer, tiene algunas características propias como ser menos frecuente, presentarse a una edad mayor, con mayor frecuencia en topografía retroareolar y ser más hormono-sensible (2-3). Creemos que el conocimiento de esta patología, el manejo de los criterios diagnósticos así como sus factores pronósticos, puede ser un aporte a la adecuada atención y tratamiento de los pacientes.
Por este motivo, realizaremos una revisión bibliográfica tratando de aportar una actualización en el tema, y mediante el análisis de 16 casos de carcinoma, determinar las características de esta patología en nuestro medio.
MATERIALES Y MÉTODOS
Los 16 casos corresponden a piezas de mastectomía fijadas en formol al 10%, incluidas en parafina según métodos de rutina. Se examinaron las láminas histológicas teñidas con hematoxilina-eosina.
Los datos de edad, antecedentes patológicos, topografía lesional, consulta intraoperatoria y macroscopía fueron obtenidos de los informes anatomopatológicos.
El análisis de la microscopía se realizó siguiendo el protocolo para patología mamaria utilizado en la Cátedra y Departamento de Anatomía Patológica del Hospital de Clínicas (Facultad de Medicina).
RESULTADOS
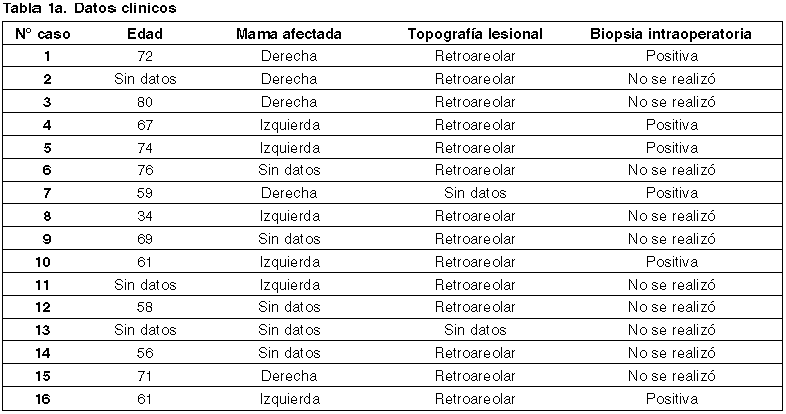
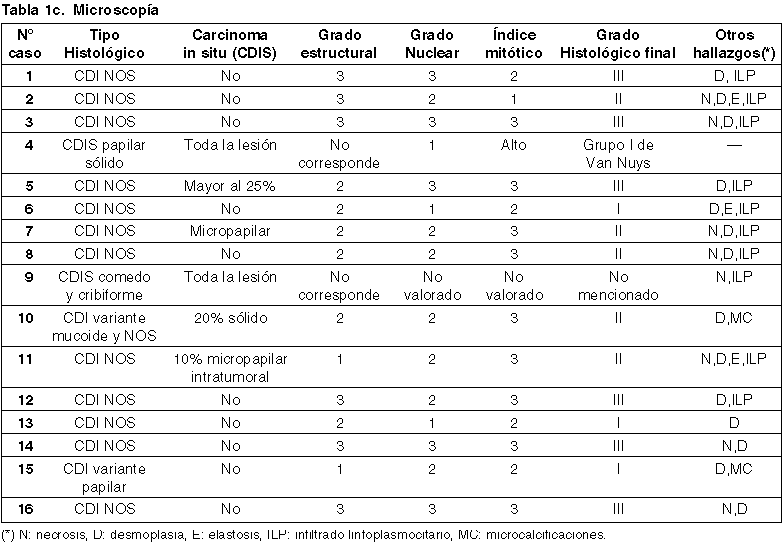
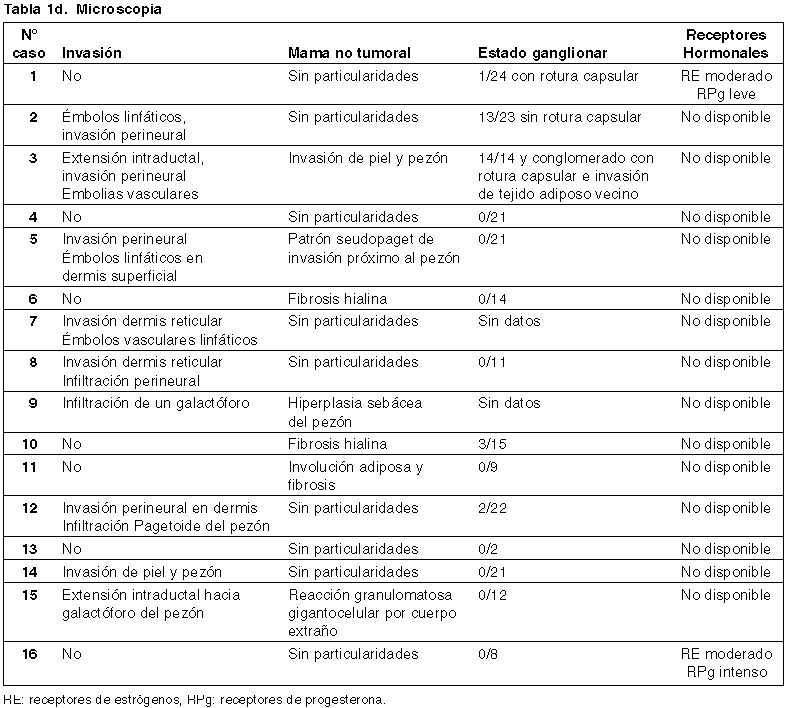
Se analizaron 16 casos, presentados en las tablas 1a-d.

La edad media fue de 64 años, con un rango entre 34 y 80 años (gráfico 1).
Gráfico 1. Edad de presentación.
En cuanto a la mama afectada, en el 31,25% (5) de los casos el carcinoma se presentó en la mama derecha, 37,5% (6) en el izquierdo, no contándose con este dato en el 31,25% (5) de los casos.
En 14 de los 16 casos analizados, la topografía lesional fue retroareolar, no contándose con el dato en los 2 casos restantes.
Se realizó consulta intraoperatoria en 6 casos (37,5%), siendo positiva para malignidad en todos ellos.
En los casos donde fue posible reconocer la lesión macroscópicamente, el eje mayor mostró un promedio de 23,6 mm, con un rango entre 38 y 5 mm. En uno de los casos no se reconoció la lesión, correspondiendo a una forma intraductal pura.
Los bordes de crecimiento fueron expansivo – infiltrantes en el 50% (8) de los casos, en el 37,5% (6) mostraron un aspecto infiltrante. Un sólo caso fue considerado como expansivo (fig. 1).
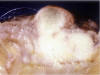
Fig. 1. Macroscopía: Carcinoma de mama masculina. Gruesa lesión de
coloración blanquecina comprometiendo el pezón.
El aspecto de la lesión apareció como circunscrito en 5 casos (31,25%) e infiltrante en otros 5 (31,25%). En 3 casos (18,75%) se describió como una lesión de tipo escirroso.
En promedio se disecaron 16 ganglios linfáticos, con un rango entre 2 y 24. En 2 casos no se realizó el vaciamiento ganglionar axilar y en un caso apareció además un conglomerado ganglionar.
El tipo histológico predominante fue el carcinoma ductal invasor de tipo NOS (75%, 12 casos), con un 12,5% (2 casos) de carcinomas ductales invasores en alguna de las variantes (papilar y mucoideo) y 12,5% (2 casos) de lesiones puramente intraductales (figs. 2, 3 y 4).
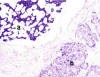
Fig. 2. Variante de carcinoma mucinoso asociada a áreas de carcinoma
ductal NOS. Caso 10 HE x40.
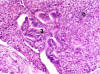
Fig. 3. Arquitectura papilar y sólida. Caso 4. HE x100.

Fig. 4. Compromiso dérmico por un carcinoma predominantemente cribiforme.
Caso 5. HE x40.
El grado histológico final fue considerado en las lesiones de tipo invasor. Un 37,5% (6 casos) mostraron ser carcinomas de alto grado histológico (III), 31,25% (5 casos) tuvieron grado histológico final II, mientras que solo el 18,75% (3 casos) fueron lesiones de bajo grado histológico (I). El grado histológico no fue considerado en las lesiones intraductales (12,5%, 2 casos).
La necrosis se observó en el 50% (8) de los casos, la desmoplasia en 87.5% (14 casos), elastosis en 18,75% (3 casos), infiltrado inflamatorio linfoplasmocitario en 62,5% (10 casos) y micro calcificaciones en 12,5% (2 casos). En 9 casos (56%) se observó algún tipo de invasión, siendo la invasión vascular bajo la forma de embolias linfáticas y la invasión perineural las más destacables. El 31% de los casos mostraron compromiso metastásico de ganglios linfáticos axilares.
Sólo contamos con el estudio de receptores hormonales en dos casos. En el caso 1, los receptores de estrógeno mostraron positividad moderada y los de progesterona leve; en el caso 16 la positividad fue moderada e intensa respectivamente (fig. 5).

Fig. 5. Receptores de estrógeno. Técnica de inmunohistoquímica que
muestra positividad moderada nuclear. Caso 16. RE x200.
DISCUSIÓN
Este estudio tuvo el propósito de realizar una actualización del tema. Analizando una serie de 16 casos de carcinoma de mama masculina, determinamos las características de esta patología en nuestro medio y las comparamos con otras series publicadas.
La edad media fue de 64 años, con un rango entre 34 y 80 años, apareciendo una mayor distribución de los casos entre los 51 y 80 años, mientras que en la literatura, la edad media de presentación en las diferentes series varía entre los 60 y 66 años, con un rango que va desde los 20 a los 97 años. (2,3,6,8,9,13-15).
Un estudio de tipo meta-análisis de 7 series, reveló que el riesgo era significativamente mayor en hombres con las siguientes características: solteros, patología mamaria benigna, ginecomastia, ascendencia judía, historia de cáncer de mama en familiares de primer grado. (8) Goss y cols en una serie colectiva de 229 hombres con cáncer de mama encontró los siguientes factores de riesgo Historia familiar de cáncer de mama (19,5%), tabaquismo (27,1%), de alcoholismo (9,6%), antecedentes de traumatismo local (9,2%), radioterapia mamaria previa (3,1%), ginecomastia clínica unilateral (4,4%) y bilateral (2.2%), ausencia de paternidad (9,2%). El riesgo también era elevado (24,5%) cuando el paciente tiene antecedente de otra neoplasia maligna.
En cuanto a la mama afectada hubo leve predilección por el lado izquierdo, como en las revisiones colectivas (8), aunque los casos en la mama derecha resultaron más agresivos. (6)
El diámetro medio de la lesión se encuentra entre 2,6 y 3,5 cm, pero el rango va de 0,5 a 12,5 cm (6-8).
La topografía lesional fue retro-areolar, en 14 de los 16 casos analizados, en dos casos no se contó con ese dato clínico. Las series revisadas comunican que en el 70 a 90% de los casos la lesión se localiza en topografía central (retro-areolar) (2,3,8,9,15). Esto difiere francamente del cáncer de mama femenino que predomina en cuadrantes externos.
Se han comunicado casos de lesiones de topografía más excéntrica, sobre todo localizadas en el cuadrante supero-externo. En raras ocasiones la lesión puede topografiarse en el pezón e invadir la mama subyacente. La presencia de tumores sincrónicos y bilaterales, clínicamente evidentes es una eventualidad extremadamente rara 0 a 1,9% (3,8), pero se ha estimado que el riesgo acumulativo de bilateralidad es menor al 3,6% (3,9,15).
En el 75 a 90% de los casos, la presentación clínica es como una tumoración indolora. Cuando no es posible detectar una tumoración, la lesión invariablemente se diagnostica debido a ulceración, retracción o secreción por el pezón. La fijación, retracción, umbilicación, edema o eccema del pezón, se presentó en el 17 a 30% de los pacientes. La ulceración ocurre en una alta proporción de casos. Hasta el 20% de los pacientes notaron cambios en la areola. En alrededor del 50% de los casos, además de la tumoración indolora, aparece alguna de las alteraciones mencionadas anteriormente (2,8,9,15,16).
La presencia de secreción serosa se asocia con tumores malignos, en el 23 al 75% de los casos (3,8,9). Cuando esta secreción es sanguinolenta y existe una tumoración mamaria, el carcinoma está presente en el 75% de los casos (9).
En el 5% de los casos, la enfermedad se puede presentar como una Enfermedad de Paget, con eritema cutáneo, cambios inflamatorios, nódulos cutáneos o lesiones satélites. Con menor frecuencia, los pacientes se presentan con dolor, edema, prurito en el pezón, o síntomas de metástasis a distancia (8).
Las características macroscópicas son uno de los aspectos principales en el análisis de esta patología. El tamaño tumoral es un importante factor pronóstico, fundamental para determinar el estadio de la enfermedad (TNM).
Analizando los resultados de nuestra serie, en los casos donde fue posible reconocer la lesión macroscópicamente, el eje mayor mostró un promedio de 23,6 mm, con un rango entre 5 y 38 mm. En uno de los casos (6,25%) no se reconoció la lesión, correspondiendo a una forma intraductal pura.
La serie de Goss y cols., una de las mayores publicadas, comunica que el 53% de los casos mide entre 2 y 5 cm, y el 34% entre 1 y 2 cm (3).
Las diferentes publicaciones distinguen dos grupos de lesiones según sus bordes de crecimiento: estelar y circunscrito.
En nuestros casos, los bordes de crecimiento fueron expansivo-infiltrativos en la mitad (8) de los casos, en el 37,5% (6) mostraron un aspecto infiltrante. Un sólo caso fue considerado como circunscrito.
El 31,25% de los casos (5) mostraron compromiso metastásico de ganglios linfáticos axilares. Al igual que en la mujer, el estadio ganglionar es un indicador pronóstico importante (17). Goss comunica un compromiso ganglionar en el 57,1% de los casos de serie analizada (3).
El tipo histológico predominante fue el carcinoma ductal invasor de tipo NOS (75%, 12 casos), con un 12,5% (2 casos) de carcinomas ductales invasores con alguna de sus variantes (papilar y mucoideo) y 12,5% (2 casos) de lesiones puramente intraductales.
Las cifras publicadas por varios autores reflejan que entre el 70 y 85% de los carcinomas de mama masculina corresponden a la variedad ductal infiltrante, siendo estas cifras mayores que en la mujer (3,6,8,9,16,18).
Cuando consideramos la presencia de un componente intraductal, este se ve en el 35 a 50% de los casos en hombres mientras aparece en el 75% de los casos femeninos (9).
El carcinoma medular, tubular, papilar, a células pequeñas y de tipo mucinoso constituye menos del 15% de los casos (8,19), hay reportes aislados de casos de carcinomas de tipo escamoso y adenoide quístico (9,20).
También se han comunicado carcinomas de tipo secretorio, uno de ellos con cambio lactacional (21-23), carcinoma oncocítico (24) y carcinoma con diferenciación mioepitelial (25).
El carcinoma de tipo papilar, con frecuencia asociado a un componente quístico prominente, es más frecuente en hombres que en mujeres. Constituye entre el 1,9 y el 5% de los casos masculinos, pero sólo el 1 a 2% de los casos femeninos (3,9,26).
La mayoría de los carcinomas papilares masculinos son intraquísticos y no invasores (9,26).
Alm y cols (1992), 51 casos de carcinomas de mama masculina con evidencias de diferenciación neuroendocrina. En estos casos, el 45% de los casos mostró inmunoreactividad para la Cromogranina (9).
En cuanto a la diferenciación apocrina, rara vez descrita, puede estar presente tanto en las lesiones intraductales como invasoras (9).
El grado histológico final (GHF) fue considerado en los tumores invasores. Un 37,5% (6 casos) mostraron un alto grado histológico (III), 31,25% (5 casos) tuvieron GHF II, mientras que sólo el 18,75% (3 casos) fueron lesiones de bajo grado histológico (I). El grado histológico no fue considerado en las lesiones intraductales.
La determinación del GHF es un factor pronóstico muy importante para el paciente. La mayoría de los casos de carcinoma de mama masculina corresponden a lesiones de alto grado histológico, tumores moderada o pobremente diferenciados, aunque en algunas series predominan los tumores de bajo grado y grado intermedio (8,9,26,27). En la serie de Willsher y cols, el 73% de los casos mostraron un grado histológico III (18).
Como fenómenos patológicos asociados al carcinoma, la necrosis se observó en el 50% (8) de los casos, la desmoplasia en 87,5% (14 casos), elastosis en 18,75% (3 casos), infiltrado inflamatorio linfoplasmocitario en 62,5% (10 casos) y micro calcificaciones en 12,5% (2 casos). No hay consenso en la literatura en cuanto al valor pronóstico de estos hallazgos (26,28).
En 9 (56,25%) casos se observó algún tipo de invasión vasculo-nerviosa, siendo la invasión vascular linfática y la perineural, las más destacables. La frecuencia de invasión vascular varía entre 4,7 y 47,2%, según las series analizadas. En este intervalo influyen el número de casos estudiados, las características clínico-patológicas y los métodos usados en la identificación de las estructuras vasculares (26,28).
Según la literatura, la presencia de embolias vasculares linfáticas de la mama es factor pronóstico desfavorable, pero el significado pronóstico de las embolias linfáticas intra tumorales no ha sido determinado (26,28).
CONCLUSIONES
Hemos estudiado una serie de 16 casos de carcinoma de mama masculina diagnosticados en nuestro medio, y en un análisis descriptivo y comparativo con la literatura universal, hemos arribado a las siguientes conclusiones:
A pesar de algunas semejanzas con el carcinoma de mama femenina, en el hombre es una patología con un perfil propio, que la hace singular.
Tiene una edad de presentación 5 a 10 años más tarde que los carcinomas de mama en la mujer.
Suelen presentarse como tumores localizados casi invariablemente en topografía central retroareolar.
El tamaño tumoral es el factor pronóstico más importante, con la desventaja en el hombre, que no se realizan estudios de screening para detectar lesiones subclínicas como en la mujer.
Histológicamente más del 70% corresponden a carcinomas ductales invasores de tipo NOS con alto GHF (II ó III). En nuestro país y probablemente debido a las características étnicas poblacionales, las referencias epidemiológicas realizadas para Estados Unidos y Europa son extrapolables.
BIBLIOGRAFÍA
Donegan WL, Redlich PN, Lang PJ, et al. Carcinoma of the breast in males: a multiinstitutional survey. Cancer 1998; 83: 498-509.
Donegan WL. Cancer of the male breast. En: Donegan WL, Spratt J, eds. Cancer of the breast. Philadelphia: WB Saunders Company, 4th ed, 1995; 765-77.
Goss PE, Reid C, Pintilie M, et al. Male breast carcinoma: a review of 229 patients who presented tho the Princess Margaret Hospital during 40 years: 1955-1996. Cancer 1999; 85: 629-39.
Guiliano AE. Breast. En: Way LW, ed. Current surgical diagnosis and treatment. Connecticut: Appleton & Lauge, 10 th ed, 1994; 312-3.
Hittmair AP, Lininger RA, Tavassoli FA. Ductal carcinoma in situ (DCIS) in the male breast: a morphologic study of 84 cases fo pure DCIS and 30 cases of DCIS associated with invasive carcinoma-a preliminary report. Cancer 1998; 83: 2139-49.
Jonasson JG, Agnarsson BA, Thorlacius S, et al. Male breast cancer in Iceland. Int J Cancer 1996; 65: 446-9.
Moore MP. Special therapeutic problems. Male breast cancer. En: Harris JR, Lippman ME, Morrow M, Hellman S, eds. Diseases of the breast. Philadelphia: Lippincott-Raven Publishers, 1996; 859-63.
Ravandi-Kashani F, Hayes TG. Male breast cancer: a review of the literature. Eur J Cancer 1998; 34: 1341-7.
Rosen PP. Carcinoma of the male breast. En: Rosen PP, ed. Rosen’s breast pathology. Philadelphia: Lippincott-Raven Publishers, 1997; 619-32.
Wick MR, Sayadi H, Ritter JH, et al. Low-stage carcinoma of the male breast. A histologic, immunohistochemical, and flow cytometric comparison with localized female breast carcinoma. Am J Clin Pathol 1999; 111: 59-69.
Yildirim E, Berberoglu U. Male breast carcinoma: a 22-year experience. Eur J Surg Oncol 1998; 24: 548-52.
Vassallo JA. Cáncer en el Uruguay. En: Vassallo JA, Registro Nacional del Cáncer. CHLCC. Montevideo; 1991: 18.
Cutuli B, Lacroxe M, Dilhuydy JM, et al. Male breast cancer: results of the treatment and prognostic factors in 397 cases. Eur J Cancer 1995; 31: 1960-4.
Messerschmidt WH, Rosato FE. Carcinoma de mama masculina. En: Strömbeck JO, Rosato FE, editors. Cirugia de la mama. Diagnostico y tratamiento de enfermedades de la mama. Barcelona: Salvat, 1990; 332-8.
Solin L. Special considerations. En: Fowble B, Goodman R, Glick J, Rosato E, eds. Breast cancer treatment. A comprehensive guide to management. St. Louis: Mosby Year Book, 1991; 536-41.
McLachlan SA, Erlinchman C, Liu FF, et al. Male breast cancer: an 11 year review of 66 patients. Breast Cancer Res Treat 1996; 40: 225-30.
Bruce DM, Heys SD, Payne S, et al. Male breast cancer: clinico-pathological features, immunocytochemical characteristics and prognosis. Eur J Surg Oncol 1996; 22: 42-6.
Willsher PC, Leach IH, Ellis IO, et al. Male breast cancer: pathological and immunohistochemical features. Anticancer Res 1997; 17: 2335-8.
Sano D, Dao B, Lankoande J, et al. Male breast cancer in Africa, apropos of 5 cases at the Ouagadougou University Teaching Hospital. Bull Cancer 1997; 84: 175-7.
Kleer CG, Oberman HA. Adenoid cystic carcinoma of the breast: value of histologic grading and proliferative activity. Am J Surg Pathol 1998; 22: 569-75.
Kameyama K, Mukai M, Iri H, et al. Secretory carcinoma of the breast in a 51-year-old male. Pathol Int 1998; 48: 994-7.
Kuwabara H, Yamane M, Okada S. Secretory breast carcinoma in a 66 year old man. J Clin Pathol 1998; 51: 545-7.
Vesoulis Z, Kashkari S. Fine needle aspiration of secretory breast carcinoma resembling lactational chages. A case report. Acta Cytol 1998; 42: 1032-6.
Damiani S, Eusebi V, Losi L, et al. Oncocytic carcinoma (malignant oncocytoma) of the breast. Am J Surg Pathol 1998; 22: 221-30.
Foschini MP, Eusebi V. Carcinomas of the breast showing myoepithelial cell differentiation. A review of the literature. Virchows Arch 1998; 432: 303-10
Rosen PP, Oberman HA. Carcinoma of the male breast. En: Rosen PP, Oberman HA, ed. Atlas of tumor pathology. Tumors of the mammary gland. Washington: Armed Forces Institue of Pathology, Third Series, Fascicle 7, 1992: 287-91
Joshi MG, Lee AK, Loda M, et al. Male breast carcinoma: an evaluation of prognostic factors contributing to a poorer outcome. Cancer 1996; 77: 490-8.
Rosen PP. Invasive duct carcinoma and morphological prognostic markers. En: Rosen PP, ed. Rosen´s breast pathology. Philadelphia: Lippincott-Raven Publishers, 1997; 275-93.