
Vol. 37, n.º 1, 2004
REVISTA
ESPAÑOLA DE
Vol. 37, n.º 1, 2004 |
Julio Escalona Zapata, M. J. Cases Huerta, M. Dolores Díez Nau, B. López Martínez Bernal
Servicio de Anatomía Patológica. Laboratorio de cultivo de tejidos. Hospital General Universitario Gregorio Marañón. Madrid.
RESUMEN
Junto a las formas clasicas, el oligodendroglioma incluye formas inusuales con aumento de la actividad proliferativa, alteraciones vasculares, tumores mixtos (oligodendroastrocitoma) y tumores con celulas eosinófilas.
El estudio con cultivo de tejidos nos ha permitido: a) confirmar el patron de crecimiento in vitro, b) la expresión de GFAP en todos los casos cultivados, c) el carácter primario de la transformación eosinófila citoplásmica.
A la luz de este estudio, puede concluirse que: a) el patrón in vitro del oligodendroglioma es característico y permite identificar este tipo tumoral sea cual sea el subtipo, b) la expresión de GFAP es constante en todas las formas de oligodendroglioma, c) la tendencia a la maduración astrocítica parace ser una capacidad propia del oligodendrocito tumoral.
Palabras clave: Oligodendroglioma, cultivo de tejidos, tumores mixtos, oligodendrogliomas eosinófilos, expresión de GFAP, transformación astrocítica.
SUMMARY
Oligodendroglioma includes not only classical tumors, but also unusual cases showing high proliferative activity, vascular changes, mixed tumors (oligoastrocytoma) and tumors with eosinophilic cells.
Tissue culture study of 14 oligodendrogloiomas show: a) the confirmation of their peculiar growth pattern, b) the expression of GFAP in all cases, c) the progressive nature of the eosinophilic changes in oligodendroglioma.
The following conclusions can be established: a) the specific behavior of all types of oligodendroglioma, b) the constant expression of GFAP in vitro, c) the capability of oligodendrroglial tumoral cells to exhibit astrocytic appearances.
Key words: Oligodendroglioma, tissue culture, mixed tumors, eosinophilic oligodendrogliomas, GFAP expression.
El oligodendroglioma es un tumor de características morfológicas bien definidas que rara vez se confunde con otras neoplasias (fig. 1). Esto sucede en el 80% de los casos, ya que en un 20% de ellos, las imágenes pueden variar por diversas causas recogidas bajo el termino de oligodendrogliomas inusuales (1). Entre estos últimos se consideran los siguientes grupos:
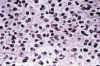
Fig. 1. Oligodendroglioma clásico. H-E 100x.
Sábana de células monomorfas, de núcleo redondo y citoplasma claro con neta
membrana, íntimamente adosadas unas a otras (patrón en panal de abejas).
1. Tumores con degeneración mucoide citoplásmica, fenómeno presente tanto en la oligodendroglia normal como tumoral (2).
2. Oligodendrogliomas clásicos a) con mitosis por encima de lo habitual, b) con células gigantes, c) con zonas fusocelulares y, especialmente d) con células eosinófilas (3-5) (fig. 2).
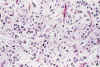
Fig. 2. Oligodendroastrocitoma. H-E 200x. En la
imagen alternan células astrocíticas de citoplasma amplio y núcleo
lateralizado, con elementos redondos de clara apariencia oligodendróglica.
3. Oligodendrogliomas polimorfos y anaplásicos (3,6).
4. Los tumores mixtos oligodendroastrocitomas (7,8) (fig. 3).
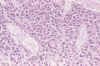
Fig. 3. Oligodendroglioma eosinófilo. H-E 200.
El tumor mantiene la disposición arquitectónica en sábana, con células
monomorfas de núcleo redondo. Sin embargo, el citoplasma es opaco y
eosinófilo, faltando la imagen en "huevo frito".
Por otra parte, cada vez tomando más cuerpo que, entre los gliomas hipocelulares de bajo grado, el numero de oligodendrogliomas es mayor de lo que se venido suponiendo (9).
Los modernos métodos, especialmente la biología molecular y la genética (10,11) tampoco han sido capaces de clarificar este tema totalmente, de modo que en la actualidad, la problemática puede resumirse del siguiente modo.
1. La naturaleza de los tumores oligodendroglicos carentes de imagen en panal de abejas, con células eosinófilas.
2. La histogénesis de los tumores mixtos.
3. Los tumores oligodendroglicos anaplásicos, no diferenciables del glioblastoma, si no contienen áreas en panal de abejas.
Esta problemática obliga al establecimiento de unos parámetros capaces de definir con un grado máximo de fiabilidad, el patrón celular propio del oligodendroglioma.
Dentro de la metódica anatomopatológica, el cultivo de tejidos a corto plazo ha sido utilizado rara vez (12-18) pero presenta una serie de ventajas que se han centrado en los siguientes puntos:
1. Obtención de una población celular pura o casi pura.
2. Desarrollo de las estructuras primarias propias del tumor con desaparición de las estructuras terciarias y, en gran parte de las secundarias.
3. Posibilidad de un cierto grado de rediferenciación in vitro (nomicoplasia) (19,20).
En este trabajo tratamos de establecer un patrón in vitro característico de este tipo de tumor capaz de ser utilizado como criterio de identificación para los distintos tipos de oligodendroglioma, tanto para las formas clásicas, como para las formas inusuales.
MATERIAL Y MÉTODOS
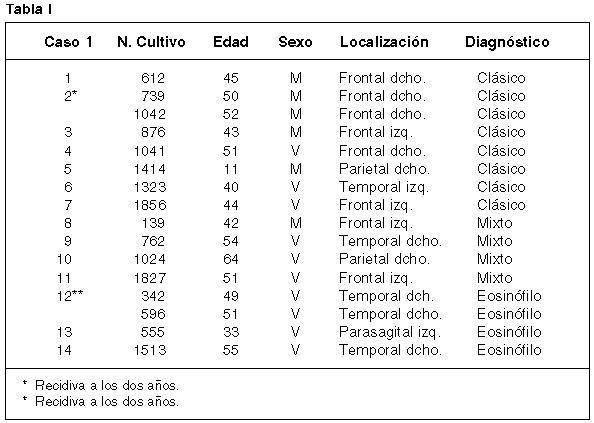
Para el presente trabajo se han utilizado 14 oligodendrogliomas procedentes del Laboratorio de Cultivo de Tejidos del Servicio de Anatomía Patológica del Hospital General Universitario Gregorio Marañón (Madrid) cuyas características clínicas se detallan en la tabla I. De ellos, 7 casos presentaron un típico patrón en panal de abejas, 4 casos respondieron al patrón mixto de oligodendroastrocitoma y 3 mostraron células ricas en citoplasma eosinófilo y opaco.
Los casos fueron estudiados con métodos convencionales (H-E), inmunohistoquímica y, eventualmente, con métodos argénticos según Río Hortega.
Para el estudio con cultivo de tejidos se utilizaron explantos en tubos rotatorios con arreglo a la técnica de Gey modificada por Kersting (14), tal y como ha sido descrita por nosotros en previas publicaciones en esta misma Revista (21), plantándose un total de 10 tubos por caso. Cada tercer día se extrajo un tubo, fijandose en alcohol-formol y tiñéndose con hematoxilina-eosina. Un explanto de cada tubo se estudio con métodos inmunohistoquímicos, con suero anti GFAP y proteína S-100.
Uno de los casos fue estudiado por medio de la cinematografía time-lapse con arreglo a las pautas previamente expuestas por Escalona y Díaz Nau (22).
RESULTADOS
Los resultados obtenidos deben separarse en tras apartados, dependiendo de las imágenes convencionales de los tumores.
El primer grupo formado por 7 casos ofreció la imagen microscópica monótona habitual en panal de abejas, baja actividad proliferativa y vascularización sin alteraciones. La conducta in vitro de estos 7 casos fue similar, observándose una emigración lenta, de células pequeñas, poligonales o piriformes, de nucleo redondo y citoplasma claro, manteniéndose, en los primeros días, la primitiva imagen en huevo frito (figs. 4 y 5). Estas células emigraron rápidamente del explanto en forma radial, mostrando un citoplasma ya escaso y brillante con óptica de fases (fig. 6), perdiéndose poco a poco la imagen en huevo frito inicial, al tiempo que desarrollaron expansiones escasas y lisas, que emergían del citoplasma bruscamente ramificándose en forma de ángulo.
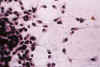
Fig. 4. Oligodendroglioma clásico. Cultivo de
tejidos al sexto día de explantación. H-E 200x. Borde de la emigración
inicial con células pequeñas con escasas prolongaciones y citoplasma opaco.
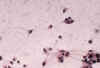
Fig. 5. Oligodendroglioma clásico. Cultivo de
tejidos al noveno día de explantación. H-E 400x. Las células emigradas van
desarrollando expansiones finas y no muy abundantes, manteniéndose a veces
agrupadas.
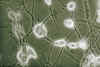
Fig. 6. Oligodendroglioma clásico. Cultivo de
tejidos al decimosegundo día de explantación. Contraste de fases 600x. Las
células emigradas muestran un soma muy refringente con prolongaciones escasas,
finas y divergentes.
Al emigrar del explanto, las células tendían a asociarse en pequeños grupos, los llamados «clusters», rodeados por las expansiones citoplásmicas. Característicamente, en el seno de la trama celulofibrilar, van a apareciendo poco a poco areolas delimitadas por haces de expansiones, en cuyo interior quedan a veces pequeños grupos de 4 a 6 células que emiten sus expansiones hacia los límites de la areola (figs. 7 y 8). Por medio de la microcinematografía, puede comprobarse la actividad pulsátil y la tendencia de los oligodendrocitos del interior de las areolas a desplazarse, incorporándose a la masa densa de la periferia, al tiempo que otras salen de estas áreas fibrilares para incorporarse a los clusters de las areolas.
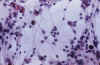
Fig. 7. Oligodendroglioma clásico. Cultivo de
tejidos al vigesimoprimer día de explantación. H-E 100x. En el centro de la
areola figura una agrupación células de siete células que emiten sus
expansiones hacia la periferia (cluster).
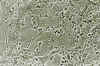
Fig. 8. Oligodendroglioma clásico. Cultivo de
tejidos al vigesimoprimer día de explantación. Contraste de fases 100x. El
desarrollo de areolas en el área de emigración es muy abundante y
característico. Entre ellas figuran las células tumorales mezcladas con sus
prolongaciones, formando tractos.
Todos los casos de este grupo han expresado GFAP, mientras que la expresión de proteína S-100 ha sido más irregular (fig. 9).
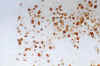
Fig. 9. Oligodendroglioma clásico. Cultivo de
tejidos al vigesimocuarto día de explantación. GFAP 200x. Las células
tumorales muestran expresión de GFAP.
Los casos 8, 9, 10 y 11, que mostraron una población doble en el estudio convencional, presentaron un patrón de crecimiento oligodendróglico, añadiéndose un segundo patrón astrocítico. El componente oligodendroglial mostro de nuevo, una emigración radial, lenta, de pequeñas células con expansiones delgadas y escasas y tendencia a la formación de «clusters». En el caso del componente astrocitario, la emigración fue más rápida, con células de mayor tamaño, inicialmente bipolares y más tarde estrelladas, con gruesas prolongaciones formando una trama fibrilar más densa que la de las áreas oligodendrogliales (fig. 10).
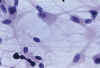
Fig. 10. Oligodendroastrocitoma. Cultivo de
tejidos al decimooctavo día de explantación 200x. El explanto muestra una
población doble, con células pequeñas, de evidente naturaleza
oligodendróglica y células mayores, de aspecto astrocítico, con soma
estrellado y núcleo lateralizado, como la del centro de la imagen. La edad del
explanto permite excluir que se trate de astrocitos incluidos y arrastrados
durante la emigración.
La expresión de GFAP ha sido positiva en ambas poblaciones celulares.
Los casos 12, 13 y 14, correspondientes a oligodendrogliomas eosinófilos, muestran un crecimiento semejante al de las formas clásicas, pero con células de tamaño mayor, con un núcleo generalmente desplazado y un citoplasma abundante, opaco y eosinófilo. En estos casos, ha sido muy constante la tendencia a la asociación en forma de grupos celulares, de los que emergen expansiones largas y escasas (fig. 11).
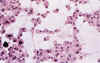
Fig. 11. Oligodendroglioma eosinófilo. Cultivo
de tejidos el decimoquinto día de explantación. H-E 100x. Las células
emigradas muestran una tendencia a formar agrupaciones más acusada que en las
formas clásicas y en ellas persiste la opacidad y eosinofilia citoplásmicas.
Obsérvese la longitud y finura de las expansiones, características de los
oligodendrogliomas.
La expresión de GFAP ha sido también intensa en todos los casos.
DISCUSIÓN
El empleo del cultivo de tejidos para el estudio del oligodendroglioma se remonta a los trabajos de Russell y Bland (12) que describieron el patrón de crecimiento in vitro y, por primera vez, la actividad pulsátil de la oligodendroglia tumoral, más tarde comprobada en material tumoral (17,22) y en la oligodendroglia normal (13). Más tarde, Kersting (14-16) aportó la mayor casuística, confirmando el patrón de crecimiento, estableciendo la diferenciación in vitro entre neoplasias astrocitarias y oligodendróglicas y apuntando la posible naturaleza glioblastomatosa de los glioblastomas de células redondas.
La conducta in vitro del oligodendroglioma clásico esta definida por un crecimiento inicial radial, lento, de pequeñas células redondeadas o poligonales, de núcleo redondo, frecuentemente excéntrico y citoplasma escaso, rápidamente, estas células pierden el halo claro perinuclear, asemejándose a los oligodendrocitos normales al tiempo que emiten escasas expansiones citoplásmicas muy finas. Estas células tienden a asociarse en pequeños grupos rodeados de numerosas prolongaciones, hasta que entre ellas se forman areolas en cuyo seno quedan, a su vez, grupos de oligodendrocitos aislados que parecen «colgar» por sus prolongaciones de los límites de la areola. Este patrón de crecimiento se mantiene ya inalterable hasta el fin del cultivo y se repite monótonamente en todos los casos estudiados.
La microcinematografía time-lapse no sólo permite demostrar la actividad pulsátil, sino los desplazamientos celulares, merced a los cuales, oligodendrocitos situados en el interior de las areolas se dirigen hacia la periferia y se integran en la red de prolongaciones, siendo sustituidos, a su vez, por otros procedentes de los límites de las areolas que pasan a integrarse en los grupos del interior de ellas (22).
Los tumores mixtos muestran un patrón in vitro semejante en lo que se refiere al componente oligodendróglico, con una emigración lenta de células que pronto se asocian en grupos y desarrollan areolas entre las fibras. Por su parte, la población astrocítica se desarrolla siguiendo el patrón clásico de emigración más rápida, disponiéndose inicialmente en forma radial con células bipolares de mayor tamaño, para transformarse rápidamente en elementos estrellados dispuestos con arreglo a un un patrón reticular (21,23). Estos dos tipos de crecimiento pueden disponerse en forma independiente, o mezclados en el interior de la misma colonia, si bien lo más frecuente es la formación de pequeños acúmulos que proliferan en forma independiente.
Los tres casos eosinófilos estudiados con cultivo de tejidos, reproducen también la morfología celular de este tipo de tumor (1), con emigración celular lenta de células redondeadas o poligonales de mayor tamaño que las de los oligodendrogliomas clásicos, con un núcleo redondo y excéntrico y un citoplasma opaco, eosinófilo y panzudo. La asociación células es reticular pero con una situación celular más laxa que en los otros casos. La formación de grupos de escasas células con prolongaciones largas y divergentes es aquí máxima.
Uno de los fenómenos más llamativos de nuestros cultivos de oligodendreoglioma ha sido la constante expresión de GFAP. Efectivamente, a partir de los días 9-12 de explantación , todos los casos han desarrollado esta expresión, la cual se ha mantenido hasta el final de la vida del cultivo. Igualmente, se ha demostrado esta expresión en cultivos permanentes en monocapa de oligodendrogliomas (24). Como consecuencia, este fenómeno puede ayudar a la comprensión de las relaciones entre astrocitos y oligodendrocitos y de las formas inusuales de oligodendroglioma.
Clásicamente, la conducta inmunohistoquímica del oligodendroglioma clásico presenta una constante falta de expresión de GFAP en sus células. Sin embargo, se ha venido insistiendo en la capacidad de algunos tumores para expresar este marcador preferente para células astrocíticas (25,26). El propio componente astrocítico de los tumores mixtos posee, como era de esperar, esta capacidad e, igualmente, los oligodendrogliomas eosinófilos son positivos a la GFAP.
Esta existencia de células GFAP positivas en los oligodendrogliomas ha sido interpretada variablemente, Wilkinson (27) considera cinco tipos de células de las que los dos primeros corresponderían a astrocitos incluidos procedentes de la periferia tal y como han sido descritos (28), los grupos 3 y 4 serían oligodendrocitos gliofibrilares y el grupo 5 estaría formado por auténticos astrocitos o células intermedias entre ellos y oligodendroglia. Nakagawa (29) describe sólo tres tipos, de los que el primero correspondería a los astrocitos incluidos ya citados, el 2 a auténticos astrocitos neoplásicos y el 3 a oligodendrocitos neoplásicos con expresión de GFAP.
En una amplia revisión del tema (30) se ha demostrado que, independientemente de los numerosos astrocitos no tumorales incluidos en los oligodendrogliomas, la expresión de GFAP es muy frecuente en los oligodendrocitos tumorales y comienza por un delicado halo perinuclear, extendiéndose más tarde a las expansiones, para, ir aumentando de su tamaño poco a poco, hasta transformarse en células con gruesas expansiones GFAP positivas, con la morfología de la llamada oligodendroglia gliofibrillar o minigemistocitos. Las peculiares características del oligodendroglioma eosinófilo han sido atribuidas al deposito de vacuolas autofágicas (5) y por lo tanto se le ha atribuido un carácter involutivo. Por el contrario, Meneses y cols. (31) han demostrado que la eosinofilia y opacidad dependen del desarrollo de microfilamentos semejantes a los filamentos intermedios de los astrocitos. Esto supone la confirmación del carácter no involutivo de la célula eosinófila, tal y como ha sido descrito por nosotros en base al cultivo de tejidos (1). Este fenómeno de la formación de fibrillas en los oligodendrocitos ha sido ya descrito en procesos no neoplásicos (32) y como sustrato de la esclerosis neuróglica de las leucodistrofias metacromáticas (33,34). De modo que parece lo más probable que bajo determinadas condiciones, la oligodendroglia puede desarrollar características astrocíticas.
Así, la relación entre oligodendroglia y astroglia parece ser más íntima de lo que se ha venido considerando sobre bases tradicionales. Inicialmente, se ha considerado que los tumores mixtos dependen de la existencia de una población tumoral doble que crecería variablemente mezclada pero, poco a poco, han ido surgiendo criterios más uncistas, habiéndose demostrado la doble diferenciación hacia astrocitos u oligodendrocitos en cultivos de células primitivas sometidos a diferentes medios nutritivos (35, 36). Igualmente, se ha descrito la existencia de dos líneas celulares a lo largo del desarrollo del sistema nervioso central, de los que una, con antígeno Ran-2 y carente de antígeno A2 B5 evolucionaría en sentido astrocítico, en tanto que la otra, carente de antígeno Ran-2 y que posee antígeno A2B5, podría evolucionar tanto hacia una población astrocítica como oligodendróglica (37). Estos trabajos reciben un cierto apoyo en la demostración de una fase temporal de la oligodendroglia medular fetal en la que estas células son capaces de expresar GFAP (38). Parece pues, que la oligodendroglia tumoral es capaz de expresar constantemente GFAP y que esta capacidad puede explicar la aparición de este fenómeno en los tumores derivados de esta línea celular, no sólo en sus formas clásicas sino en los tumores mixtos y en los eosinófilos.
Sobre estas bases, creemos que pueden establecerse las siguientes conclusiones:
1. Existe un patrón de comportamiento in vitro característico del oligodendroglioma caracterizado por: a) emigración lenta de pequeñas células provistas de expansiones escasas y finas; b) asociación celular reticular; c) formación de grupos celulares situados en el interior de areolas; d) expresión de GFAP; e) actividad pulsátil y desplazamientos celulares de las células de los grupos hacia las áreas reticulares y viceversa.
2. Este patrón, incluida la expresión de GFAP, persiste en las áreas oligodendróglicas de los tumores mixtos y en los oligodendrogliomas eosinófilos.
3. Los oligodendrogliomas clásicos, los tumores oligodendróglicos eosinófilos y los oligodendroastrocitomas parecen representar grados progresivos de transformación astrocítica de la misma línea celular.
BIBLIOGRAFÍA
Escalona Zapata J. Uncommon oligodendrogliomas. Acta Neuropathol (Berlin) Suppl. VII. 1981, 94-96.
Grinker R, Stevens E. Mucoid degeneration of he oligodendroglia and the formation of free mucin in the brain. Arch. Path. 1929; 8: 171-179.
Escalona Zapata J. Tumores del Sistema Nervioso Central. Ed. Complutense, Madrid 1996.
Zülch KJ, Wechsler W. Pathology and classification of gliomas. En. Krayenbuhl-Maspes-Sweet: Progr. Neurol. Surg. Vol 2. pp. 1-84, 1968.
Takei Y, Mirra SS, Miles MML. Eosinophilic granular cells in oligodendrogliomas. Cancer 1976, 1968-1976.
Zulch KJ. Brain Tumors. Their biology and pathology. 3 ed. Springer Berlin 1986.
Cooper ERA. The relation of oligocytes and astrocytes in cerebral tumors. Path. Bact. 1935; 44: 259-266.
Hart MN, Petito CK, Earle KM. Mixed gliomas. Cancer, 1974; 33: 134-140.
Burger PC. What is an Oligodendroglioma? Brain Pathol. 2002; 12: 257-259.
Reifenberger J, Reifenberger G, Liu I, James CD, Wechsler W, Collins VP. Molecular genetic analysis of oligodendroglial tumors shows preferential allelic delections on 19q and 1p. Amer. J. Pathol. 1994; 145: 1175-1190.
Kraus JA, Kopman J, Kastel P, Mainz D, Brandner S, Schramm J, Louis DN, Wiestler OD, von Deimling A. Shared allelic losses of chromosomes 1p and 15q suggest a common origin of oligodendrogliomas and oligoastrocytoma. J. Neuropath. Exp. Neurol. 1995; 54: 91-95.
Russell DS, Bland JOW. A study of gliomas by the method of tissue culture. J. Path. Bact. 1933; 36: 273-238.
Lumsden CB, Pomerat CM. Normal oligodendrocytes in tissue culture. A preliminary report of the pulsátil glial cells in tissue cultures from corpus callosum in the normal adult rat brain. Exper. Cell. Res. 1951; 2: 103-114.
Kersting G. Die Gewebszüchtung menschlicher Hirngeschwülste. Springer Berlin 1961.
Kersting G. Die Odrnung der Hirngeschwülste und ihr Verhalten in vitro. World Neurol. 1961; 2: 406-415.
Kersting G. Tissue culture of human gliomas. En: Krayenbuhl-Maspes-Sweet: Progr. Neurol. Surg. Vol. 2, pp. 165-202, 1968.
Pomerat CM, Crue BL, Kasten FH. Observations on the cytology of an oligodendroglioma cultivated in vitro. J. Nat. Cancer Inst. 1964; 33: 517-533.
Escalona Zapata J, Díez Nau MD. Cultivo de tejidos en el estudio de los tumores del sistema nervioso central. En: Escalona Zapata J. Tumores del Sistema Nervioso Central. pp. 685-718. Ed. Complutense. Madrid 1996.
Costero I, Pomerat CM. Standard cellular morphology of gliomas in vitro as compared with explanted normal brain cells. Excerpta Med. Sec. 8. 1955; 821.
Escalona Zapata J, Díez Nau MD. The astrocytic nature of glioblastoma demonstrated by tissue culture. Acta Neuropathol (Berlin) 1981; 53: 155-160.
Escalona Zapata J, Díez Nau MD. Estudio de los astrocitomas y sus derivados por medio del cultivo de tejidos. Patología 1983; 16: 23-4514.
Escalona Zapata J, Díez Nau MD. Algunos aspectos dinámicos de la patología de los gliomas. En: Centenario de la Neurología en España. pp. 283-290. Barcelona 1983.
Escalona Zapata J, Díez Nau MD. Distinctive growth patterns between cerebral and cerebellar astrocytomas. A tissue culture study. Histopathology 1981; 5: 639-650.
Miranda Nieves G. Características del crecimiento in vitro de las neoplasias gliales. Tesis Doctoral. Universidad de Sevilla 1989.
Herpers MJHM, Budka H. Glial Fibrillary Acidic Protein in oligodendroglial tumors. Gliofibrillary oligodendroglioma and transitionaal oligoastrocytoma as subtypes of oligodendroglioma. Acta Neuropathol (Berlin) 1984; 64: 265-272.
Van der Meulen JDM, Houthoff HJ, Ebels EJ. Glial Fibrillary Acidic Protein in human gliomas. Neuropath. Appl. Neurobiol. 1978; 4: 177-190.
Wilkinson IMS, Anderson JR, Holmes AE. Oligodendrogliomas: An analysis of 42 cases. J. Neurol. Neurosurg. Psychiatr. 1987; 50: 304-312.
Escalona Zapata J. Astrocytes in brain tumors. Differentiation or trapping? Histol. Histopathol. 1994; 9: 325-332.
Nakagawa WY, Perentes E, Rubinstein LJ. Inmunohistochemical characterization of oligodendrogliomas: An analysis of multiple markers. Acta Neuropathol. (Berlin) 1986; 72: 15-22.
Escalona Zapata J, Miranda Nieves G, Gutiérrez Molina M, Martínez AM. Astrocitos en oligodendrogliomas. Estudio con impregnaciones argénticas, inmunohistoquímica cultivo de tejidos. Patología 2002; 35: 533-542.
Meneses ACO, Kepes JJ, Sternberger NH. Astrocytic differentiation of neoplastic oligodendrocytes. J. Neuropath. Exp. Neurol. 1982; 41: 368.
Zulch KJ. Problems in the diagnosis of oligodendroglioma. Excerprta Med. Vol. 8. 1955; 8: 816.
Lumsden CB. The study by tissue culture of tumours of the nervous system. En: Russell-Rubinstein: Tumours of the Nervous System. E. Arnold Ed. 1971.
Gaszo L, Afra D, Muller W. Supratentorial recurrences of gliomas. Tissue culture studies with astrocytomas and oligodendrogliomas. Acta Neuropathol (Berlin) 1978; 44: 135-139.
Raaf MC, Miller RH, Noble MA. A glial progenitor cell that develops «in vitro» into astrocyte or an oligodendrocyte depending of culture medium. Nature 1983; 303: 390-396.
Raaf MC, Abney ER, Miller RH. Two lineal lineages diverge prenatally in rat optic nerve. Dev. Biol. 1984; 106: 53-60.
De la Monte SM. Uniform lineage of oligodendrogliomas. Am. J. Pathol. 1989; 135: 520-540.
Choi BH, Kim RC. Expression of glial fibrillary acidic protein in inmature oligodendroglia. Science 1984; 223: 407-408.