
Vol. 36, n.º 4, 2003
REVISTA
ESPAÑOLA DE
Vol. 36, n.º 4, 2003 |
Vicente Vicente Ortega1, Cristina Martínez Conesa1, Josefa Yáñez Gascón1, Miguel Alcaraz Baños2, Manuel Canteras Jordana3
Cátedras de 1 Anatomía Patológica, 2 Radiología y Medicina Física y 3 Bioestadística. Facultad de Medicina. Universidad de Murcia. vvortega@um.es
RESUMEN
Antecedentes: El Melanoma es el responsable del 75% de las muertes por cáncer de piel, fundamentalmente por las metástasis, preferentemente pulmonares. La dificultad del tratamiento estriba en las interacciones entre las células tumorales y los mecanismos homeostáticos que usurpan. Métodos: Hemos establecido un modelo experimental de metástasis pulmonares mediante la inoculación intravenosa de células B16F10 a ratones Swiss, a los que administramos oralmente apigenina, diosmina y rutina, y el etanol como disolvente, durante once días antes y veintiuno después de la inoculación, procediéndose al sacrificio de los animales y al recuento de los nódulos en toda la superficie pulmonar mediante lupa estereoscópica. Resultados: La inoculación de 0,5 x 106 células de B16F10 origina un modelo metastásico pulmonar cuantificable macroscópicamente, destacando en el tratamiento el grupo del etanol (II) con el mayor número de nódulos pulmonares y diferencias significativas respecto a los restantes grupos (330±86 nódulos, con un aumento del 87% respecto al control (I)). Ninguno de los grupos de los flavonoides mostró diferencias significativas respecto al control ni entre sí, solo el grupo tratado con Diosmina (V) presentaba menor número de nódulos que el control (I) y diferencias significativas con el tratado con etanol (II) con una reducción del 52% de los nódulos observados. Conclusión: El grupo tratado con etanol casi duplicaba las metástasis pulmonares del control. Todos los tratados con flavonoides presentaban reducción del número de metástasis respecto del etanol, siendo el de diosmina el de mayor reducción (52%).
Palabras clave: Melanoma B16F10, metástasis pulmonares, flavonoides, etanol, ratones Swiss.
SUMMARY
Antecedents: Melanoma is responsible for 75% of skin cancer deaths, basically through metastasis, usually pulmonary. The difficulty of treatment lies in the interactions between the tumoral cells and the homeostatic mechanisms that they usurp. Methods: An experimental model of pulmonary metastasis was established by intravenous inoculation of B16F10 cells in Swiss mice. Eleven days before inoculation and 21 days after (when they were sacrificed), the mice were orally administered apigenin, diosmin and rutin, and ethanol as solvent. The nodules on the lung surface were examined by stereoscopy. Results: The inoculation of 0,5 x 106 B16F10 melanoma cells provides a macroscopically quantifiable pulmonary metastasic model. The ethanol group (II) had significantly more pulmonary nodules than the other groups with a mean of 330(86 nodules, 87% with respect to the control (I). None of the flavonoid groups showed significant differences with respect to the control or between each other, and only group V (diosmin) showed fewer nodules than the control (I) and significant differences with ethanol (52% fewer nodules). Conclusions: Ethanol administered orally almost doubled the pulmonary metastases of the control. All the flavonoids reduced them although only diosmin resulted in fewer nodules than in the control, showing a 52% reduction with respect to ethanol.
Keywords: B16F10 Melanoma, pulmonary metastasis, flavonoids, ethanol, Swiss mice.
INTRODUCCIÓN
El melanoma, aunque representa alrededor del 1% de todos los cánceres y menos del 10% de los cutáneos, es el responsable del 75% de las muertes por cáncer de piel (1). La mayoría de las muertes son debidas a las metástasis, que suelen ser resistentes al tratamiento convencional. En diversas revisiones, las metástasis pulmonares por melanoma ocurrían entre el 12,2% (2) y el 20% (3) de los enfermos, siendo el segundo órgano en preferencia después de los ganglios linfáticos y el primero de las metástasis viscerales (4).
La mayor dificultad de su tratamiento parece deberse a las múltiples interacciones existentes entre las células tumorales que metastatizan y los mecanismos homeostáticos que usurpan. Estudios recientes de Fidler (5) han demostrado que el microambiente del órgano huésped puede influir sobre el crecimiento e invasión, así como en la respuesta de las metástasis a la quimioterapia, por lo que esta debe ir dirigida tanto a las células metastásicas como a los factores homeostáticos que las facilitan. En este sentido durante los últimos años se han ensayado distintos compuestos fenólicos, entre los que destacan los flavonoides, como agentes dietéticos potencialmente quimioprotectores frente al cáncer, pues parecen capaces de actuar en todas las etapas del proceso de carcinogénesis: presentan efectos antiangiogénicos (6), antioxidantes (7) e incluso acción aniproliferativa (inhibición del daño en el ADN y enzimas implicadas en la transducción de señales como kinasas, fosfolipasas, fosfodiesterasas, etc.) (8). Diversos estudios experimentales han demostrado que algunos flavonoides presentan capacidad para reducir el número de las metástasis pulmonares y aumentar la supervivencia de los animales, aunque su mecanismo de acción todavía no es bien conocido (9-15).
El objetivo de nuestro trabajo ha sido establecer un modelo experimental de metástasis pulmonares mediante la inoculación intravenosa de células B16F10 en ratones y estudiar el posible efecto antimetastásico de tres flavonoides (apigenina, diosmina y rutina).
MATERIAL Y MÉTODOS
Línea celular: Hemos utilizado la sublínea B16F10 altamente metastásica del melanoma murino B16 (European Collection of cell cultures. U.K.), cultivada con medio mínimo esencial Eagle (EMEM, Gibco, E.E.U.U) tamponado a PH 7,2-7,4, y con un 10% de suero bovino fetal (SBF, Gibco, E.E.U.U), estreptomicina y penicilina (100 µg/ml y 100 u/ml, respectivamente) comprobando la ausencia de Micoplasma,spp. mediante fluorescencia directa con el colorante especifico para ADN (H33233, Hoecht, Alemania). Todas las operaciones se han realizado en cabina de flujo laminar vertical Cultair ASB tipo II, con el instrumental adecuadamente esterilizado. Los cultivos se mantuvieron constantemente a una temperatura de 37ºC, humedad relativa del 98% y atmósfera con un 5% de CO2 en una estufa de cultivo Cytoperm de Haereus (Germany), cambiando el medio de cultivo cada 48 horas.
Animales: 80 Ratones albinos Swiss hembras, de 10-12 semanas y 28-36 g en el comienzo del estudio procedentes del Servicio de Animales de Laboratorio de la Universidad de Murcia (licencia 30030-2AB, Ministerio de Agricultura, Pesca y Alimentación (orden 13-10-88)).
Flavonoides: Apigenina , diosmina y rutina fueron proporcionados por Furfural español, S.A. (Murcia) y disueltos en etanol (Merck, Madrid) al 1,2%, en la bebida y comida. Esta fue preparada triturando el pienso de mantenimiento A04 (Panlab, Barcelona, España), al que añadimos agua para obtener un pellet que secamos a 80ºC, y suministrado «ad libitum». Al agua de bebida añadimos 0,2% del flavonoide disuelto al 1,2% en etanol, que se administró también «ad libitum».
Procedimiento experimental
Los tres flavonoides y el vehículo para su disolución (etanol) se administraron durante los 11 días previos a la inoculación de las células tumorales y durante los 21 días posteriores a ésta, en la ingestión de la comida y la bebida. La implantación de las células se realizó mediante inoculación en la vena lateral de la cola, según dos modelos diferentes con el fin de conseguir el idóneo para el estudio macroscópico de las metástasis pulmonares:
A) Inoculación de 0,5 x 106 células/ 200 µl de medio de cultivo (10 ratones).
B) Inoculación de 1 x 106 células/ 200 µl de medio de cultivo (10 ratones).
Posteriormente, seleccionamos el modelo A, procediendo a la inoculación de las células tumorales a 60 ratones y la administración de las sustancias descritas en la ingesta de comida y bebida, realizando los siguientes grupos, de 10 ratones cada uno:
I) Control (sólo inoculación de 0,5 x 106 células).
II) Etanol (1,2%, como vehículo de disolución).
III) Apigenina (0,2% disuelto al 1,2% de etanol)
IV) Rutina (0,2% disuelto al 1,2% de etanol).
V) Diosmina (0,2% disuelto al 1,2% de etanol).
A los 21 días da la inoculación de las células tumorales, los animales fueron sacrificados por dislocación cervical, realizándose la autopsia y el estudio macroscópico de todos los órganos, que fueron fijados en formol neutro tamponado al 10% y procesados por el método habitual para su inclusión en parafina.
El estudio de los nódulos metastásicos fue realizado con una lupa estereoscópica Olympus contando todos los nódulos que se observaban en la superficie de los cinco lóbulos pulmonares.
Análisis estadístico: Realizamos una estadística descriptiva calculando la distribución de frecuencias, media, error de la media y desviación típica, máxima y mínima. La comparación entre grupos se realizó con un análisis de varianza trasformando logarítmicamente los datos. Este análisis se complementó con comparaciones entre pares de medias con el método de la mínima diferencia significativa.
RESULTADOS
En el experimento realizado previamente como piloto, para establecer el modelo idóneo que nos permitiera cuantificar los nódulos metastásicos pulmonares, observamos que la variante correspondiente a la inoculación de 1 x 106 células tumorales originaba una siembra metastásica tan extensa y difusa que impedía el contaje de los nódulos individualizadamente, imposibilitando por tanto su cuantificación; mientras que la inoculación de 0,5 x 106, aunque también daba lugar a metástasis en todos los animales, estas se disponían como nódulos de distintos tamaños pero usualmente separados entre sí, por lo que elegimos esta segunda variante como modelo para estudiar los efectos de los distintos tratamientos ensayados.
En la gráfica 1 se presenta el recuento de los nódulos metastásicos pulmonares. La observación más relevante correspondía al grupo II al que se administró exclusivamente etanol, por ser el vehículo en el que administrábamos disueltos los flavonoides ensayados, y que constituye el grupo real de comparación para valorar sus efectos. Este grupo de etanol presentaba el mayor número de nódulos metastásicos, con una media de 330,07±86,72, que supone un incremento del 87% respecto al control (grupo I) y era además el único grupo que mostraba diferencias significativas con los restantes grupos: rutina y apigenina p≤0,05 y diosmina p≤0,001.
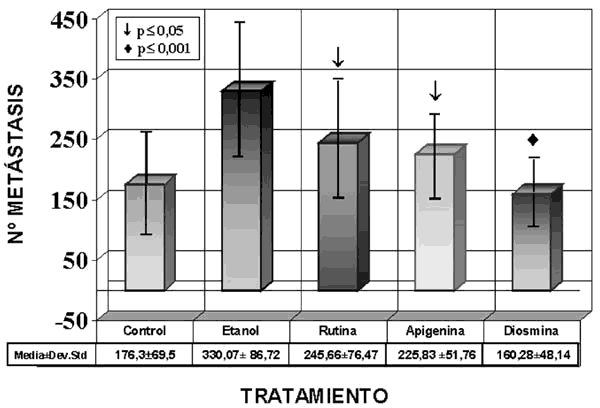
Gráfica 1. Frecuencia de
presentación de nódulos metastásicos pulmonares en los cinco grupos de
ratones utilizados (media±desviación estándar).
Los grupos tratados con flavonoides (III, IV y V) no mostraban diferencias estadísticamente significativas con el grupo control (I), ni tampoco entre sí. Solo la diosmina (V) presentaba una ligera reducción de los nódulos pulmonares respecto al grupo control. No obstante , la comparación de los resultados obtenidos en los grupos tratados con los flavonoides debe realizarse con el grupo tratado con etanol (II) que constituye un segundo grupo control, ya que todos los agentes ensayados eran vehiculizados con la misma concentración de etanol.
En este sentido los tres grupos tratados con flavonoides mostraban menor número de nódulos pulmonares que el etanol, siendo el grupo tratado con diosmina (V) el que mostró la mayor reducción (52%) de nódulos metastásicos y diferencias estadísticamente significativas (p≤0,001). Los restantes flavonoides también presentaban una disminución del número de metástasis con una reducción del 32% la apigenina (III) y un 26% la rutina (IV) (p≤0,05).
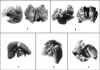
Fig. 1. Características
macroscópicas de los nódulos metastásicos pulmonares: a (grupo control, I), b
(etanol, II), c (apigenina, III), d (rutina, IV), e (diosmina, V).
DISCUSIÓN
Desde los clásicos estudios de Fidler en 1973 (16), sobre la predilección de las células del melanoma por colonizar diversos órganos, han sido numerosos los trabajos realizados que demuestran que diversas sublíneas del melanoma murino B16 mostraba predilección por determinados órganos: pulmón (16), cerebro (17,18), ovario (19) e hígado (20), debido a la presencia de distintas características químicas, inmunológicas o de adhesión en la superficie de las células tumorales (21). Asimismo, de las distintas líneas celulares ensayadas, la B16F10 que hemos elegido para nuestro estudio, y la B16BL6 han demostrado la mayor capacidad metastásica en el pulmón (22).
También se han utilizado distintas concentraciones de células tumorales para la inducción de las metástasis pulmonares, en nuestro estudio la concentración idónea fue la de quinientas mil células, con la que obtuvimos una colonización pulmonar perfectamente cuantificable (pues la de un millón originaba una siembra difusa imposible de cuantificar), de modo similar a lo descrito por Lentini (23) con la misma línea celular y número de células inoculadas diferenciándose en la supervivencia de los animales; en su estudio morían hacia los 15 días del implante, mientras que nuestros animales lo hacían alrededor de 21 días. Por otra parte Kikkawa (24) utilizando la otra línea metastásica (B16BL6), observó que la inoculación de un millón de células a través de la vena lateral de la cola originaba un número diez veces mayor de nódulos pulmonares que con 500.000 células, mientras que la inoculación de 10.000 células no originaba metástasis pulmonares. En cuanto al método para el estudio cuantitativo de los nódulos pulmonares hemos seguido el utilizado en los estudios previos de Menon (10), Bosserhoff (25) y Fuzii (26) mediante el recuento de nódulos de la superficie pulmonar en los cinco lóbulos con una lupa estereoscópica (Olympus).
El hecho más destacable de nuestro estudio correspondió a que el grupo tratado con etanol, a la misma concentración que en los otros grupos en los que se utilizó como vehículo en el que se administraron disueltos los flavonoides, mostraba el mayor número de metástasis, incluso mayor que el grupo control (con un incremento del 87% respecto a este).
En la bibliografía consultada los efectos del etanol sobre las metástasis pulmonares son contradictorios, ya que cuando las células de B16BL6 eran inyectadas subcutáneamente, el etanol mostraba un efecto inhibitorio disminuyendo el número de nódulos pulmonares respecto al control (27-29); mientras que cuando las células eran inyectadas en la vena lateral de la cola, el etanol potenciaba el efecto metastásico aumentando significativamente los nódulos pulmonares (28) de modo similar a lo observado en nuestro estudio.
El mecanismo íntimo de acción del etanol no está aclarado habiéndose descrito tanto efectos vasculares como inmunológicos; de modo que algunos estudios experimentales relacionan la administración moderada de etanol con la alteración de distintos factores de crecimiento como erb B2, erb B3 y erb B4 sobre las células T47D del cáncer de mama, estimulando su proliferación (30); así como sobre el factor del crecimiento del endotelio vascular (VEGF), lo que favorecería la angiogénesis y por tanto el crecimiento tumoral (31). No obstante, también se ha descrito su acción sobre la fibrinolisis endotelial (32) que podría inhibir por tanto las metástasis pulmonares. Estudios in vitro han descrito el efecto estimulante del etanol sobre la migración celular tanto en el melanoma B16F10 (33) como en otras líneas como la T47D del cáncer de mama (34). Incluso se ha descrito el papel inmunosupresor que puede realizar el etanol al disminuir la actividad citotóxica de los linfocitos NK (35).
Por el contrario, los tres flavonoides que ensayamos mostraban un efecto inhibidor de la capacidad metatastizante de las células B16F10, aunque con resultados muy variables entre sí, siendo el más efectivo la diosmina que originó una reducción del 52% del número de nódulos pulmonares respecto al grupo del etanol, seguido en eficacia por la apigenina (32 %) y la rutina (26 %).
La diosmina fue el flavonoide más eficaz pues logró diferencias significativas (p≤0,001) respecto al grupo del etanol, y el único que no hemos encontrado descrito en la bibliografía en relación con el tratamiento de las metástasis pulmonares del melanoma, aunque sí ha sido ensayado sobre otros tumores, tanto in vivo sobre neoplasias esofágicas inducidas experimentalmente en ratas (36) en el cáncer de vejiga urinaria (37), como in vitro sobre células Caco-2 del cáncer de colon humano, en las que la diosmina reducía el crecimiento tumoral al estimular la apoptosis por activación de la Caspasa-3, según Kuntz (38).
El segundo flavonoide en eficacia, la apigenina, originó un 32% de reducción de las metástasis respecto al etanol, y la hemos encontrado descrita tanto en el tratamiento del melanoma como de otros cánceres. Estudios recientes de Caltagirone (15), sobre los efectos de distintos flavonoides, describen la apigenina como muy activa al originar disminución del crecimiento tumoral y de la capacidad metastásica en pulmón del melanoma B18BL6. Iwashita (39) responsabiliza la disminución del crecimiento a la inducción de apoptosis celular. Diversos estudios in vitro señalan como responsable de la disminución del crecimiento celular a la inhibición de la enzima protein-kinasa, implicada en el ciclo celular, aunque puede actuar en distintas fases dependiendo de la línea celular. Bloquean la fase G2 del ciclo celular en células de melanoma de coroides humano y cáncer de mama (8,40) y en queratinocitos normales (41); y bloquean la fase G1 en fibroblastos de ratón (42).
El flavonoide menos eficaz en nuestro estudio, la rutina, con un 26 % de reducción respecto al etanol, contrasta con el de Menon (10), para quien la rutina es el segundo en eficacia de los nueve ensayados, con una reducción del 71,2 % de las metástasis sobre la misma línea celular (B16F10), con un gran aumento de la supervivencia de los animales (63,59 %). En nuestro estudio no hemos estudiado la supervivencia, ya que sacrificamos a todos los animales a los 21 días post-implante. Sin embargo en un estudio posterior (12) la rutina aumentaba el crecimiento del melanoma B16 y de las metástasis pulmonares.
Los flavonoides propuestos por algunos autores como una opción terapéutica adyuvante del melanoma metastásico pulmonar, han mostrado resultados variables e incluso contradictorios. Resultan necesarios nuevos estudios que profundicen en sus mecanismos de acción. Recientemente se han relacionado con su capacidad para inhibir las metaloproteínas (14) así como en su capacidad para originar enlaces de hidrógeno que estabilizan las proteínas de la membrana basal, especialmente el colágeno haciéndolas menos susceptibles a la degradación proteolítica (15).
Agradecimientos
Agradecemos D. Víctor Bolarín Lucas, técnico en Anatomía Patológica, por su asistencia técnica, y a los Dres. Antonia Bernabeu y a Jose Muñoz y a Dña. Juana García, del Servicio de Cultivo Celulares (SACE) de la Universidad de Murcia su ayuda en el trabajo realizado en el citado servicio.
Este trabajo ha sido parcialmente financiado con una ayuda de programa PETRI-1995-0582-OP.
BIBLIOGRAFÍA
Hall HI, Miller DR, Rogers JD, Bewerse B. Update on the incidence and mortality from melanoma in the United States. J Am Acad Dermatol 1999; 40: 35-42.
Harpole DH Jr, Johnson CM, Wolfe WG, George SL, Seigler HF. Analysis of 945 cases of pulmonary metastatic melanoma. Thorac Cardio Surger 1992; 103: 743-50.
Majeski, J. Bilateral breast masses as initial presentation of widely metastatic melanoma. J Surg Oncol 1999; 72: 175-7.
Aderson CLM, Tabacof J, Legha SS. Malignan melanoma: Biology, Diagnosis, and Management. Medical oncology: a comprehesive review (serie online) 1997; 2: (22 pantallas). Disponible: URL: http://www.cancernetwork.com/textbook/ morev32.htm.
Fidler IJ. Critical determinants of metastasis. Semin Cancer Biol 2002; 12: 89-96.
Fotsis T, Pepper MS, Akatas E, Breits S, Rasku S et al. Flavonoids, dietary-derived inhibitors of cell proliferation and «in vitro» angiogenesis. Cancer Research 1997; 57: 2946-51.
Burda S, Oleszek W. Antioxidant and antiradical activities of flavonoids. J Agric Food Chem 2001; 49: 2774-9.
Casagrande F, Darbon J M. Effects of sructurally related flavonoids on cell cycle progression of human melanoma cells: regulation of cyclin-dependent Kinases CDK2 and CDK1. Bioch Pharma 2001; 61: 1205-15.
Taniguchi S, Fujiki H, Kobayashi H, Go H, Miyado K, Sadano H, Shimokawa R. Effect of (-)-epigallocatechin gallate, the main constituent of green tea, on lung metastasis with mouse B16 melanoma cell lines. Cancer Lett 1992; 65: 51-4.
Menon LG, Kuttan R, Kuttan G. Inhibition of lung metastasis in mice induced by B16F10 melanoma cells by polyphenolic compounds. Cancer Lett 1995; 95: 221-5.
Menon LG, Kuttan R, Nair MG, Chang YC, Kuttan G. Effect of isoflavones genistein and daidzein in the inhibition of lung metastasis in mice induced by B16F-10 melanoma cells. Nutr Cancer 1998; 30: 74-7.
Drewa G, Schachtschabel DO, Palgan K, Gzanka A, Sujkowska R. The influence of rutin on the weight, metastasis and melanin content of B16 melanotic membrana in C57BL/6 mice. Neoplasma 1998; 45: 266-71.
Li D, Yee JA, Mc Guire MH, Murphy PA, Yan L. Soybean Isoflavones reduce experimental metastasis in mice. J Nutrition 1999; 129: 1075-8.
Menon LG, Kuttan R, Kuttan G. Anti-metastatic activity of curcumin and catechin. Cancer Lett 1999; 141: 159-65.
Caltagirone S, Rossi C, Poggi A, Ranelletti FO, Natali P G, Brunetti M, Aiello FB, Piantelli M. Flavonoids apigenin and quercetin inhibit melanoma growth metastatic potential. Int J Cancer 2000; 87: 595-600.
Fidler IJ. Selection of sucessive tumor lines for metastasis. Nature (new Biol.) 1973; 242: 148-9.
Raz A, Hart IR. Murine melanoma. A model for intracranial metastasis. Br J Cancer 1980; 42; 331-41.
Miner KM, Kawaguchi T, Uba GW, Nicolson GL: Clonal drift of cell surface, melanogenic and experimental metastatic properties of in vivo-selected brain meninges-colonizing murine B16 melanoma. Cancer Res 1982; 4: 4631-8.
Brunos KW, Nicolson GL. Selection of malignant melanoma variant cell lines for ovary colonization. J Supramol Struct 1979; 11; 517-28.
Tao TW, Burger MM, Matter A, Vogel K. Liver-colonizing melanoma cells selected from B-16 melanoma. Int J Cancer 1979; 23: 854-7.
Nicolson GL, Dulskin K, Basson C, Welch DR. Preferential organ attachment and invasion in vitro by B16 melanoma cells selected for differing metastatic colonization and invasive properties. Invasion Metastasis 1985; 5: 144-58.
Gath L, Nicolson GL, Dulski K. Organ specificty of metastatic tumor colonization is related to organ-selective growth properties of malignant cells. Int J Cancer 1986; 38: 289-94.
Lentini A, Kleinman HK, Mattioli P, Autouri-pezzoli V, Nicolini L, Pietrini A, et al. Inhibition of melanoma pulmonary metastasis by methylxanthines due to decreased invasion and proliferation. Melanoma Res 1998; 8: 131-7.
Kikkawa H, Imafuku H, Tsukada H, Oku N. Possible of immune surveillance at the initial phase of metastasis produced by B16BL6 melanoma cells. Febs Lett 2000; 467: 211-6.
Bossserhoff AK, Echtenacher B, Hein R, Buettner R. Functional role of melanoma inhibitory activity in regulating invasion and metastasis of malignant melanoma cells in vivo. Melanoma Res 2001; 11: 417-21.
Fuzii HT, Travassos LR. Transiente resistance to B16F10 melanoma growth and metastasis in CD43 -/-mice. Melanoma Res 2002; 12: 9-16.
Meadows GG, Elstad CA, Blank SE, Galluci RM, Pfister L J. Alcohol consumption suppresses metastasis of B16BL6 melanoma in mice. Clin. Exp. Metastasis. 1993; 12: 191-9.
Blank SE, Meandows GG. Ethanol modules metastatic potencial of B16Bl6 melanoma and host responses. Alcohol Clin Exp Res 1996; 20: 624-8.
Spitzer JH, Nunez N P, Meadwos S A, Galluci R M, Meadows G G. The modulation of B16BL6 melanoma metastasis is not directly mediated by cytolytic activity of natural killer cells in alcohol-consuming mice. Alcohol Clin Exp Res 2000; 24:837-44.
Luo J, Miller MW Ethanol enhances erb-B-mediated migration of human breast cancer cells in culture. Breast Cancer Res Treat 2000; 63: 61-9.
Gu J W, Elam J, Sartin A, Li W, Roach R, Adair TH. Moderate levels of ethanol induce expression of vascular endothelial growth factor and stimulated angiogenesi. Am J Physiol Regul Integr Comp Phisiol 2001; 281: R365-72.
Tanbengwa EM, Grenett H E, Benza RL, Abou-Agag LH, Trenak JK, Wheeler CG, Booyse FM. Ethanol induced up regulation of the urokinase receptor in cultured human endothelial cells. Alchol Clin Exp Res 2001; 25: 163-70.
Silberman S, McGarvey TW, Comrie E, Perky B. The influence of ethanol on cell membrana fluidity, migratión, and invasion of murina membrane cells. Exp Cell Res 1990; 189: 64-8.
Zhu Y, Lin H, Wanz M, Li Z, Wiggins R, Luo, Y. Up-regulation of trascription of smooth muscle myosin alkali light chain by ethanol in human breast cancer cells. Int J Oncol 2001; 18: 1299-305.
Galluci RM, Meadows GG. Ethanol consumption reduces the cytolytic activity of lymphokine-activated killer cells. Alcohol Clin Exp Res 1995; 19: 402-9.
Tanaka T, Makita H, Kawabata K, Mori H, Kakumoto M, Satoh K, Hara A, Sumida T, Fukutani K, Tanaka T, Ogawa H. Modulation of N-methyl-N-anmylnitrosamine-induced rat oesophageal tumourigenesis by dietary feeding of diosmin and hesperidin both alone and in combination. Carcinogenesis 1997; 18: 761-9.
Yang L, Yee JA, McGuire MH, Graef GL. Effect of dietary supplementation of soybeans on experimental metastasis of melanoma cells in mice. Nutr Cancer 1997; 29: 1-6.
Kuntz S, Wenzel U, Daniel H. Comparative analysis of the effects of flavonoids on proliferation, cytotoxicity, and apoptosis in human colon cancer cell lines. Eur J Nutr 1999; 38: 133-42.
Iwashita K, Kobori M, Yamaki K, Tsushida T. Flavonoids inhibit cell growth–induce apoptosis in B16 melanoma 4A5 cells. Biotechnol Biochem 2000; 69: 1813-20.
Yin F, Guiliano A E, Law RE, Van Herle A J. Apigenin inhibits growth and induces G2/M arrest by modulating Cyclin-CDK regulators and ERK MAP Kinase activation in breast carcinoma cells. Anticancer Research 2001; 21: 413-20.
Lepey DM, Li B, Birt DF, Pelling J C. The chemopreventive flavonoid apigenin induce G2/M arrest in keranocytes. Carcinogenesis 1996; 17: 2367-75.
Lepley D M, Pelling J C. Induction of p21/WAF1 and G1 cell-cycle arrests by chemopreventive agent apigenin. Mol Carcinog 1997; 19: 74-82.