
Vol. 36, n.º 4, 2003
REVISTA
ESPAÑOLA DE
Vol. 36, n.º 4, 2003 |
Ana Puras1, Cristóbal Solozábal2
1 S. de Patología y 2 S. de Nefrología. Hospital Universitario Virgen del Camino. Pamplona. ana.puras.gil@cfnavarra.es
RESUMEN
Se comentan los hallazgos morfológicos del hiperparatiroidismo en los enfermos con insuficiencia renal crónica, correlacionándolos con el estadio evolutivo de la enfermedad y con los resultados analíticos. Se exponen las dificultades diagnósticas del patólogo, en esta área de la patología endocrina y la necesidad de contar con información clínica para una correcta evaluación de cada caso.
Palabras clave: hiperparatiroidismo secundario y terciario, insuficiencia renal crónica, hiperplasia nodular de paratiroides.
SUMMARY
Morphological patterns of hyperparathyroidism in patients with chronic renal failure are reviewed in relation to the evolution of the illness and the laboratory findings. Diagnostic challenges in this area of endocrine pathology are discussed, and the need for clinical information to adequately evaluate individual cases is commented.
Key words: secondary and tertiary hyperparathyroidism, chronic renal failure, nodular hyperplasia of parathyroids.
INTRODUCCIÓN
Con frecuencia nos vemos en la necesidad de diagnosticar lesiones para cuya correcta evaluación resulta imprescindible contar con la información clínica de quienes, a través de la muestra que remiten para estudio, nos consultan; y, sin embargo, muchas veces no es así y somos los propios patólogos los que debemos estudiar y valorar la historia clínica, algo a lo que en absoluto somos ajenos, pero que acarrea una mayor dedicación a cada caso. Esta necesidad es especialmente manifiesta en patología funcional y en particular en patología endocrina, ya que en ellas resulta imprescindible el manejo de los parámetros clínicos y analíticos, además de los morfológicos.
Hiperparatiroidismo
Por hiperparatiroidismo se entiende una situación de alteración en el equilibrio entre la hormona paratiroidea (PTH) y el calcio sérico que conduce a cifras elevadas de PTH en sangre; los niveles de calcio sérico variarán según sea la causa que produzca el disturbio metabólico (1).
Las causas más habituales que van a ser objeto de remisión de las glándulas paratiroides al patólogo, se exponen en la tabla 1; en este artículo nos centraremos más específicamente en el estudio del hiperparatiroidismo secundario causado por la insuficiencia renal crónica, patología que en los últimos años viene siendo objeto de especial dedicación por nefrólogos y patólogos.

Hiperparatiroidismo secundario
Consiste en un aumento del parénquima de la glándula paratiroides, con afectación de todas las glándulas, que es debido a un estímulo conocido que provoca una hipersecreción de hormona paratiroidea (2,3). Son múltiples los cuadros patológicos que conducen a él, pero la causa más común es el fallo renal crónico. También puede ocurrir en pacientes con osteomalacia, debido al déficit en la dieta de vitamina D o calcio, o debido a la ausencia o escasez de receptores de vitamina D o de receptores de PTH (pseudohipoparatiroidismo), o a una hipomagnesemia severa, entre otros.
En la insuficiencia renal crónica (IRC), la vitamina D activa circulante llega a estar disminuida, en situación de hipovitaminosis D, así cómo sus receptores en las glándulas paratiroides; paradójicamente, estos pacientes se van haciendo cada vez más resistentes a la vitamina D y al calcio conforme avanza la enfermedad. Se produce consecuentemente una hiperplasia difusa de todas las glándulas paratiroides, aunque en algunos casos puede resultar alguna atrófica, frenada por la hiperplasia más marcada de las restantes.
Acción de la vitamina D
La vitamina D procedente de la dieta se absorbe en el intestino en forma de colecalciferol, se hidroxila inicialmente en el hígado transformándose en 25(OH)Vit. D, principio escasamente activo y vuelve a hidroxilarse doblemente en el riñón, transformándose en Calcitriol (1-24-25(OH)3Vit.D), que es el principio más activo. En la IRC, este último paso no ocurre y es esa hipovitaminosis D que consecuentemente se origina la que provoca un hiperparatiroidismo por varios mecanismos: a) disminuye la absorción de calcio; b) disminuye la sensibilidad al calcio; el número de receptores de calcio es menor (4); c) induce una hiperplasia de las glándulas paratiroides al no estar inhibidos los genes de proliferación celular por dicha vitamina, ni activados los de apoptosis; d) su ausencia mantenida provoca a su vez una insensibilidad celular a la vitamina D en las células paratiroideas, por disminución del número de receptores de esta vitamina; una de las pruebas clínicas para estadificar el hiperparatiroidismo está basada en la respuesta o no a dosis suprafisiológicas de vitamina D. Todo ello unido a la retención de fosfatos por su deficiente eliminación por el riñón, conduce a un estímulo crónico de las glándulas paratiroides.
Es tan relevante el papel que juega la vitamina D que puede alterar el resultado del estudio isotópico con 99mTecnecio-MIBI, y resulta imprescindible retirar su administración, si se le ha prescrito al paciente, para poder diferenciar preoperatoriamente entre adenoma (capta el MIBI) e hiperplasia (no lo capta), en un hiperparatiroidismo primario, o entre las fases terciaria (no lo capta) y cuaternaria (lo capta) que luego comentaremos, del hiperparatiroidismo secundario en los pacientes renales, en los que si no se procede así el resultado del estudio con MIBI es mucho menos útil. También hay que tener en cuenta que, en ausencia de vitamina D, el hueso se hace cada vez más insensible a la hormona paratiroidea y para su habitual remodelación necesitará unos niveles más elevados de ella; por esta razón, ante las cifras muy elevadas de PTH que se producen en el hiperparatiroidismo de la IRC, las alteraciones morfológicas óseas raramente se expresarán en forma de «tumores pardos», como ocurre en el hiperparatiroidismo primario, sino más bien en forma de osteoporosis.
Parámetros bioquímicos
La tendencia normal en estos pacientes es hacia la hipocalcemia (6) pero, aunque las cifras de calcio en sangre sean normales, el paciente se comporta como si de una hipocalcemia se tratara, por la insensibilidad que a su vez existe en la glándula hacia el calcio; la cifra de calcemia dependerá de la fase en que nos encontremos, en base a que se haya producido o no movilización del calcio óseo. Así, podremos encontrarnos con una hipo, normo, o hipercalcemia.
En los pacientes con IRC se habla de hiperparatiroidismo cuando la cifra de PTH es superior a los 150 picogramos (pg)/ml; los valores estándar son de 30-60 pg/ml; es decir, se considera dentro de los límites normales una cifra triple de la habitual. La acción de la PTH consiste en movilizar del hueso el calcio y el fósforo; esto provoca que en estos enfermos, en sangre, el fósforo esté aumentado (7-10) porque además no se elimina debido a la afectación renal; por ello se administran también quelantes del fósforo para evitar su absorción en el intestino; en unas ocasiones son cálcicos (acetato, carbonato), si el calcio está sólo discretamente aumentado; si el calcio está muy elevado (>de 50 el producto calcio x fósforo) se pueden dar quelantes sin calcio ya que existe el riesgo de que aparezca calcifilaxia, calcificación de vasos, etc. Los quelantes con aluminio sólo se podrán dar, durante pocos días, en hiperfosforemias muy severas, con monitorización del aluminio, ya que el producto que más estimula la secreción de PTH es el fósforo y es primordial descenderlo de manera rápida, no siendo aconsejable dar tratamiento con vitamina D sin haber controlado previamente los fosfatos; y cuando se prescriba se administrará por la noche, con estómago vacío, en dosis suprafisilógicas para provocar picos elevados en sangre y no propiciar el que se absorba el fósforo de la dieta al absorberse el calcio, si se administra con la ingesta.
Las cifras que pueden llegar a alcanzarse en los pacientes con IRC de PTH son muy elevadas ya que influyen en ellas, como hemos visto, tres factores: la cifra de calcio, la de fósforo y la de vitamina D (11,12).
En cambio, si algunos pacientes tienen además de su insuficiencia renal una diabetes u otra enfermedad «debilitante», o una edad avanzada, hay que tener en cuenta que la consecuencia clínica puede ser un «hipoparatiroidismo» en vez de un hiperparatiroidismo, por una menor respuesta del organismo a los estímulos; en estos casos, el tratamiento irá destinado a crear un «hiperparatiroidismo» relativo, provocando cifras aún más altas de PTH circulante.
Por todo ello, lo mejor es prevenir el hiperparatiroidismo, controlando el fósforo, manejando el calcio en valores normales y teniendo unas cifras de PTH controladas, aportando la vitamina D nocturna.
Aspectos morfológicos del hiperparatiroidismo secundario, «terciario» y «cuaternario»
En los estadios iniciales, las glándulas están uniforme y ligeramente aumentadas y poco a poco van incrementando más su tamaño, aunque ese crecimiento puede no ser igual en cada una de ellas (fig. 1), llegando su peso a superar los 6.000 mg. En los estadios posteriores se observa un patrón nodular de proliferación (fig. 2), con formación de bandas de fibrosis, con zonas de hemorragia y degeneración quística. Es la denominada fase terciaria del hiperparatiroidismo.
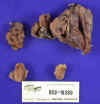
Fig. 1. Hiperplasia general de la
paratiroides, una de ellas, yuxtatiroidea.
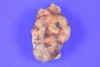
Fig. 2. Paratiroides hiperplásica,
nodular, en la I.R.C.
Microscópicamente, una mezcla de los diferentes tipos celulares se encuentran en el hiperparatiroidismo secundario; lo más común es que aparezca inicialmente un aumento de células principales vacuoladas por aumento del contenido en glucógeno; como en otras formas de hiperplasia paratiroidea, los lípidos intracelulares están disminuidos; un aumento de células oncocíticas, habitualmente en forma de nódulos, se ve también con frecuencia.
La hiperplasia en los pacientes con IRC mantenida, estadio terciario, suele ser multinodular, formando nódulos hiperplásicos rodeados por gruesas bandas fibrosas, el denominado «encinturamiento», muy característico de esta fase, con focos de hemorragia (fig. 3) y depósitos de hemosiderina. Estas gruesas bandas fibrosas son las que impiden que la vitamina D penetre en la glándula, ya que lo hace por difusión; como consecuencia, cada vez se hace más insensible a ella, contribuyendo al mantenimiento de la hiperfunción paratiroidea, por lo que en esta fase, sólo la exéresis quirúrgica resolverá el problema.

Fig. 3. Imagen panorámica, nodular,
de una glándula paratiroides.
A veces, en una de las glándulas se puede producir un crecimiento homogéneo, clonal, de las células, que muestra también, a su vez, una cápsula fibrosa gruesa; es la que se denomina fase cuaternaria, con la imagen morfológica del adenoma (fig. 4) o más raramente del carcinoma; en ambos casos deberá estar asentado sobre una base de hiperplasia en fase terciaria, para diferenciarlo del adenoma (o del carcinoma) del hiperparatiroidismo primario en los que los criterios morfológicos diagnósticos serán diferentes, como comentaremos a continuación.

Fig. 4. Diferentes tipos celulares en
la hiperplasia.
El diagnóstico diferencial, en los pacientes renales, debe incluir también, al menos inicialmente, al hiperparatiroidismo primario, motivado por un adenoma o un carcinoma, si solamente hay una glándula aumentada, o por una hiperplasia, si lo están todas. La biopsia de una segunda glándula, como habitualmente se hace intraoperatoriamente, nos permitirá confirmar los dos primeros, habitualmente; ante un hiperparatiroidismo de larga evolución, en pacientes con IRC, deberemos estar informados de este antecedente desde el mismo momento en que se realiza la biopsia intraoperatoria, o mejor todavía previamente, ya que el carcinoma y las glándulas hiperplásicas del hiperparatiroidismo secundario tienen muchas características en común, como son el mayor tamaño (suelen ser palpables en el acto quirúrgico), los gruesos tractos fibrosos que penetran en el parénquima formando nódulos (5,13) con focos de hemorragia, las elevadas cifras de calcio (suelen estar más elevadas en el carcinoma) y de hormona paratiroidea (suelen estar más elevadas en la hiperplasia en fase terciaria o cuaternaria de la IRC). No obstante, diagnosticar un carcinoma, algo de por sí difícil en los estadios iniciales, cuando se desconoce si ha dado metástasis, lo es más en estos pacientes si no se cuenta con la adecuada información clínica, o si se ha desarrollado un carcinoma en una hiperplasia en fase cuaternaria; es en esos excepcionales casos es cuando se deberán aplicar los criterios más estrictos para hacer un diagnóstico de malignidad (14) en el hiperparatiroidismo.
Por otra parte, para distinguir el hiperparatiroidismo secundario (que requerirá tratamiento médico sólo) del «hiperparatiroidismo terciario o cuaternario» (que requerirán tratamiento quirúrgico), será necesario saber si el paciente ha respondido o no a la administración de vitamina D en la forma en que hemos indicado y saber si el producto calcio x fósforo ha estado bien controlado.

Fig. 5. Parathormona en las células
hiperplásicas.
Aportación al tratamiento
La correlación de estos hallazgos morfológicos con los parámetros bioquímicos y con la evolución de la enfermedad ha permitido establecer unas pautas de actuación más adecuadas en los pacientes con insuficiencia renal crónica. En las primeras fases de la enfermedad, cuando lo que hay es una hiperplasia inicial en el contexto del hiperparatiroidismo secundario, éste se puede resolver con tratamiento médico, con lo que se considera como una «paratiroidectomía química», es decir con dosis elevadas, suprafisiológicas, nocturnas, de vitamina D, tal como ya hemos indicado. Pero, cuando la enfermedad está muy avanzada, por no haber seguido un estricto control del calcio, fósforo y de la hormona paratiroidea y ha aparecido el «encinturamiento», los nódulos intraparenquimatosos rodeados por gruesas bandas de tejido fibroso, esas glándulas paratiroides son insensibles a la vitamina D, y se trata ya de una fase terciaria, que no responde al tratamiento médico y cuya única solución es hacer una paratiroidectomía total quirúrgica. La experiencia clínica confirma que, tras la exéresis de las cuatro glándulas, aunque los pacientes mantengan bajos niveles de PTH (siempre queda alguna fuente pequeña de producción de hormona), los riesgos de hipocalcemia se pueden controlar con un aporte elevado de calcio y de vitamina D activada, que en fase postoperatoria se administrará con la ingesta. Si por el contrario se deja parte de una glándula paratiroides en la zona cervical, o se implanta en el antebrazo, como era el procedimiento habitual hasta hace poco tiempo (15), se corre el riesgo de que el cuadro se repita en ese tejido remanente y que el abordaje quirúrgico posterior resulte casi imposible, si se trata del cuello; o, que si se ha implantado en un antebrazo, se produzca un crecimiento desordenado de esa glándula con la cápsula incompleta, con la posibilidad de que ocurra una diseminación hacia el pulmón, con múltiples metástasis y una hipercalcemia no controlable.
Se ha descrito la asociación del hiperparatiroidismo secundario con carcinoma papilar de tiroides, a veces diagnosticado casualmente al realizar la paratiroidectomía (16).
CONCLUSIÓN
Existe una clara correlación clínico-patológica entre el estadio de enfermedad, los parámetros analíticos y los hallazgos morfológicos en estos pacientes; pero resulta imprescindible conocer los antecedentes para evitar una inadecuada interpretación diagnóstica, si no se reconocen fácilmente los patrones de hiperparatiroidismo secundario en estos pacientes, y sobre todo si se plantea el diagnóstico diferencial con un proceso maligno de las glándulas paratiroides. Si el hiperparatiroidismo generado por una insuficiencia renal crónica puede estar adecuadamente controlado, al Servicio de Patología no deberán llegarle glándulas paratiroides correspondientes a un hiperparatiroidismo secundario en fase terciaria o cuaternaria, ya que el control analítico podrá ser sólo médico (paratiroidectomía «química») durante mucho tiempo.
BIBLIOGRAFÍA
Slatopolsky E. The role of calcium, phosphorus and vitamin D metabolism in the development of secondary hyperparathyroidism. Nephrol Dial Transplant 1998; 13 (Supl. 3): 3-8.
Slatopolsky E, Brown A, Dusso A. Pathogenesis of secondary hyperparathyroidism. Kidney Int 1999; (Supl. 73): S14-19.
Silver J: Molecular mechanisms of secondary hyperparathyroidism. Nephrol Dial Transplant 2000; 25 (Supl. 5): 2-7.
Jódar Gimeno E, Martínez Díaz-Guerra G, Azriel Mira S, Hawkins Carranza F. Receptor sensible a calcio y parathormona. REEMO 2002; 11: 64-6.
Lloyd RV, Douglas BR, Young WF: Parathiroid gland. En: Endocrine diseases (Atlas of nontumor pathology, first series, fascicle 1). Bethesda: AFIP; 2002. p. 45-83.
Grimelius L, Äkerström G, Johansson H, Juhlin C, Rastad J. The parathyroid glands. En: Functional Endocrine Pathology. Vienna: Blackwell; 1991. p. 375-95.
Locatelli F, Cannata-Andía JB, Drueke TB, Horl WH, Fouque D, Heimburger O, Ritz E. Management of disturbances of calcium and phosphate metabolism in chronic renal insufficiency, with emphasis on the control of hyperphosphataemia. Nephrol Dial Transplant 2002; 17: 723-73.
Brown EM, Gamba G, Riccardi D, Lombardi M, Butters R, Kifor O, Sun A, Hediger MA, Lytton J, Hebert SC. Cloning and characterization of an extracellular Ca(2+)-sensing receptor from bovine parathyroid. Nature 1993; 366: 575-80.
Brown EM, MacLeod RJ. Extracellular calcium sensing and extracellular calcium signaling. Physiol Rev 2001; 81: 239-97.
Conigrave AD, Quinn SJ, Brown EM. L-amino acid sensing by the extracellular Ca2+-sensing receptor. Proc Natl Acad Sci USA 2000; 97: 4814-19.
Hernandez A, Torres A, Concepcion MT, Salido E. Parathyroid gland calcium receptor gene expression is not regulated by increased dietary phosphorus in normal and renal failure rats. Nephrol Dial Transplant 1996; 11(Supl. 3): 11-14.
Almadén Y, Canalejo A, Ballesteros E, Anón G, Canadillas S, Rodríguez M. Regulation of arachidonic acid production by intracellular calcium in parathyroid cells: effect of extracellular phosphate. J Am Soc Nephrol 2002; 13: 693-98.
Lewin E, Garfia B, Recio FL, Rodríguez M, Olgaard K. Persistent downregulation of calcium-sensing receptor mRNA in rat parathyroids when severe secondary hyperparathyroidism is reversed by an isogenic kidney transplantation. J Am Soc Nephrol 2002; 13: 2110-16.
Puras Gil A, López Cousillas A. Actitud del patólogo en la patología quirúrgica de la glándula paratiroides. Patología 1988; 28: 392-96.
Gasparri G, Camandona M, Abbona GC, Papotti M, et al. Secondary and tertiary hyperparathyroidism: causes of recurrent disease after 446 parathyroidectomies. Ann Surg 2001; 233: 65-9.
Klyachkin ML, Sloan DA: Secondary hyperparathyroidism: evidence for an association papillary thyroid cancer. Am Surg 2001; 67: 397-99.