
Vol. 35, n.º 3, 2002
REVISTA
ESPAÑOLA DE
Vol. 35, n.º 3, 2002 |
José Pérez-Requena, María Jesús Palomo-González, José Manuel Baena-Cañada1, Juan Antonio Córdoba-Doña2, Enrique Alonso-Redondo3, Antonio Escolar-Pujolar2
Servicios de Anatomía Patológica, Oncología Médica1, Medicina Preventiva2 y Oncología Radioterápica3 del Hospital Universitario Puerta del Mar de Cádiz.
RESUMEN
Planteamiento: En este artículo se valora la influencia pronóstica de la expresión imnunohistoquímica de la proteína p53 en el cáncer de mama. Material y métodos: Hemos estudiado 100 casos de carcinoma de mama tratados con mastectomía, en los que investigamos la relación entre la expresión inmunohistoquímica de la proteína p53 y la supervivencia libre de enfermedad y supervivencia global con un seguimiento medio de 52 meses. Resultados: El 25% de los tumores presentaron inmunotinción nuclear para proteína p53. En el análisis univariante, los casos p53-positivos mostraron una menor supervivencia libre de enfermedad y supervivencia global comparados con los p53-negativos. En el análisis multivariante, la expresión de proteína p53 se asoció de forma independiente con una menor supervivencia libre de enfermedad y supervivencia global. Conclusiones: La expresión inmunohistoquímica de proteína p53 se ha comportado como un factor independiente de mal pronóstico en el cáncer de mama.
Palabras clave: Cáncer de mama, p53, factores pronósticos.
SUMMARY
Background: In this article we evaluate the prognostic value of the immunohistochemical expression of p53 protein in breast cancer. Material and methods: We collected 100 cases of breast carcinoma treated with mastectomy and investigated the relationship between immunohistochemical expression of p53 protein and disease-free survival and overall survival with long-term follow-up (median, 52 months). Results: 25% of the tumors showed p53-positive nuclear immunostaining. In univariate analysis, p53-positive cases had a shorter disease-free survival and overall survival rate than those p53-negatives. In multivariate analysis, expression of p53 protein was independently associated with reduced disease-free survival and overall survival. Conclusions: Immunohistochemical expression of p53 protein behaved independently as a significant poor-prognosis factor for breast cancer.
Key words: Breast cancer, p53, prognosis factors.
INTRODUCCIÓN
Se han llevado a cabo numerosos estudios para identificar factores pronósticos en el cáncer de mama, siendo el tamaño tumoral (1,2) la existencia y número de ganglios axilares metastásicos (3,4) y la presencia de metástasis a distancia (5) los únicos factores que han demostrado una influencia pronóstica independiente en el análisis multivariante de forma constante en los distintos estudios. Existen otros factores que han demostrado su influencia pronóstica, pero que dependen de los anteriormente citados, o, al menos, aún no han sido aceptados de una forma generalizada como factores pronósticos indepedientes. Entre estos últimos están el grado histológico, la invasión cutánea y el estado de los receptores hormonales.
El gen supresor tumoral p53 juega un papel importante en un gran número de neoplasias humanas, pudiéndose detectar sus alteraciones de forma indirecta mediante inmunohistoquímica, ya que la proteína «mutada» es más estable y de mayor vida media, lo que la hace detectable inmunohistoquímicamente. La expresión inmunohistoquímica de la proteína p53 es un factor controvertido en cuanto a su posible influencia pronóstica (6,7-26).
En este trabajo estudiamos el significado pronóstico de la expresión inmunohistoquímica de la proteína p53 en el cáncer de mama, es decir, su asociación a la supervivencia global y libre de enfermedad.
MATERIAL Y MÉTODOS
Se ha llevado a cabo el estudio en 100 mujeres afectas de cáncer de mama a las que se realizó mastectomía y linfadenectomía axilar, siendo estudiadas las piezas quirúrgicas en el Servicio de Anatomía Patológica del Hospital Puerta del Mar, de Cádiz, entre diciembre de 1991 y octubre de 1993. Se ha realizado un estudio descriptivo de una serie de parámetros clínico-patológicos y un estudio de cohorte retrospectivo de supervivencia.
Los indicadores pronósticos utilizados han sido la supervivencia global y la supervivencia libre de enfermedad (tiempo transcurrido entre el diagnóstico y la aparición de recurrencia local, regional o a distancia) y el seguimiento medio ha sido de 52 meses.
Se realizó la fijación en formol al 10% para el estudio histológico convencional y en Methacarn para los estudios inmunohistoquímicos. El estudio de receptores de estrógenos y progesterona fue realizado mediante dos métodos: el inmunohistoquímico y el bioquímico, utilizando para este último tejido tumoral ultracongelado en nitrógeno líquido.
La técnica de inmunohistoquímica empleada fue el método de la fosfatasa alcalina y se utilizaron los anticuerpos monoclonales prediluidos del receptor de progesterona y proteína asociada al receptor de estrógeno (p 29) de Laboratorios Bio-Genex, para la proteína p53 se utilizó el anticuerpo prediluido DO-7, (Dako) y para el PCNA el clon 19A2. La valoración inmunohistoquímica se hizo según los siguientes criterios: 1) para p53 se consideró válida la tinción nuclear y positivos aquellos casos en que más de un 10% de los núcleos presentaban inmunotinción y negativos cuando la presentaban menos del 10%, 2) para los receptores hormonales se realizó una evaluación semicuantitativa, valorándose en cada caso el porcentaje de células positivas y la intensidad de la inmunotinción, nuclear para el receptor de progesterona (RP) y citoplasmática para la proteína asociada al receptor de estrógenos (RE). Se calculó un valor que denominamos Histocore para RE y Progescore para RP mediante la siguiente fórmula: [intensidad (0, 1, 2 ó 3) + 1] x células positivas (%), considerando los valores < 100 como negativos y positivos los 100, tanto para Histocore como para Progescore, 3) el PCNA (Antígeno Nuclear de Proliferación Celular) se valoró de forma cuantitativa, considerándose positivas las células que mostraban una tinción nuclear de intensidad al menos II/III y calculándose el porcentaje de células positivas por campo tras medir 10 CGA en cada tumor.
Se evaluaron el tamaño tumoral, el índice de celularidad (número de núcleos de células tumorales por campo de 1.000 aumentos), el índice de actividad mitótica, y de manera semicuantitativa, con valores I-III, correspondiendo el I a grado escaso/bajo, el II a grado medio y el III a grado intenso/alto, fueron evaluados el grado histológico, el grado nuclear y la infiltración linfoide del estroma tumoral. Se evaluó de forma cualitativa el tipo histológico, el tipo de márgenes tumorales (infiltrativos o expansivos), la presencia o ausencia de necrosis tumoral, la invasión vascular y la infiltración de la piel. En los ganglios axilares fueron evaluados los siguientes parámetros: el número de ganglios metastásicos, el tipo de invasión (parcial, completa o masiva y la presencia de invasión extracapsular) y el grado de histiocitosis sinusal (escasa o ausente, moderada e intensa). En cada tumor se calculó el índice pronóstico morfométrico multiparamétrico de Baak (27) y el índice pronóstico de Nottingham (28).
El estudio morfométrico se realizó en un microscopio Nikon Microphot y un equipo analizador de imágenes VIDS II que, mediante delimitación de contornos, evaluó los siguientes parámetros: área nuclear (micras cuadradas), perímetro nuclear (micras), factor forma (corresponde a la fórmula 4 x Pi x Area/Perímetro2 y es evaluado como 1 para el círculo y como < 1 para elipse y estructuras irregulares), proyección sobre el eje X (en micras, es un parámetro considerado equivalente al diámetro nuclear medio) y proyección sobre el eje Y (en micras).
El estudio estadístico se hizo mediante los programas EPIINFO y SPSS aplicando las siguientes pruebas estadísticas:
Análisis univariante de supervivencia mediante el método de Kaplan-Meier y el test de log rank para supervivencia global y supervivencia libre de enfermedad para cada una de las variables.
Análisis multivariante mediante el método de Cox (modelo de riesgos proporcionales) para supervivencia global y libre de enfermedad. En ambos casos se alcanzó el mejor modelo predictivo utilizando el método de «purposeful selection» para la inclusión o exclusión de variables de interés. Se investigó asimismo la posible presencia de interacciones.
RESULTADOS
Estadística descriptiva de las variables
La edad de las pacientes fue de 25 a 87 años (media: 55), la localización más frecuente el cuadrante superoexterno (47%) y el tamaño medio 3,45 cm. Presentaron metástasis axilares el 57% de los casos, con una media de ganglios afectados de 3,02.
El 80% fueron carcinomas ductales, 9% carcinomas lobulillares, 8% carcinomas medulares y 3% carcinomas mixtos. El grado histológico (siguiendo el criterio de Bloom y Richardson) fue 1 en el 11% de los casos, 2 en el 70% y 3 en el 19%. La media de los valores morfométricos (en micras) fue la siguiente: área nuclear: 68.87, perímetro nuclear: 31,74, factor forma: 0,80 y proyecciones nucleares sobre los ejes x e y 9,65 y 9,26, respectivamente.
El índice de actividad mitótica presentó un valor medio de 11,3, con un 25% presentando entre 0 y 3 mitosis, un 32% entre 4 y 10 y un 43% más de 10. El PCNA presentó un valor medio de 13,27% de células con inmunotinción nuclear, con un 56% de casos con baja tasa de proliferación (menos del 12% de las células positivas) y un 44% con alta tasa de proliferación (más del 12% de las células positivas).
El índice de celularidad medio fue de 96.8 células por campo de 1.000 aumentos, observándose invasión vascular en el 64% de los casos y necrosis tumoral en el 69%.
Con respecto a los márgenes tumorales, el 94% de los tumores mostraron un patrón de crecimiento infiltrativo, mientras el 6% fueron de crecimiento expansivo. El infiltrado linfoide intratumoral fue ligero o inexistente en el 60% de los casos, moderado en el 31% e intenso en el 9%. El 17% de los casos presentaron infiltración cutánea.
El Indice Pronóstico Morfométrico Multiparamétrico (IPMM) de Baak presentó valores comprendidos entre 0,99 y 2,52 (media: 0,72), y un 46% de las pacientes tuvieron un índice de buen pronóstico (menos de 0,60). El Indice Pronóstico de Nottingham presentó valores que oscilaron entre 2,3 y 7,5 (media: 4,53), con el 22% con valores menores de 3,4, el 45% con valores comprendidos entre 3,4 y 5,4, y el 33% con valores mayores a 5,4.
Los RE y RP determinados por inmunohistoquímica presentaron un Histocore (RE) con un valor medio de 171, con un 8% de casos negativos (valor menor de 100) y un 92% positivos (mayor o igual a 100), y un Progescore (RP) con una media de 77, siendo el 58% negativos (valor menor de 100) y el 42% positivos (valor mayor o igual a 100). Los valores de los RE determinados bioquímicamente se hallaron comprendidos entre <3 y 583 fentomoles/mg, con una media de 81, siendo el 20% negativos (valor <3) y el 80% positivos (valor 3). Los valores de los RP determinados por el método bioquímico presentaron un valor mínimo de <10 fentomoles/mg y máximo de 321 fentomoles/mg, con una media de 42, siendo el 37% negativos (valor<10) y el 63% positivos (valores 10).
La proteína p53 fue positiva (inmunotinción nuclear en más del 10% de las células) en el 25% de los casos y negativa (menos del 10% de núcleos teñidos) en el 75% restante.
Relación de las distintas variables con la supervivencia libre de enfermedad y global (analisis univariante)
Los resultados para la supervivencia libre de enfermedad se muestran en la tabla I. Los parámetros que se han asociado de forma significativa (p<0,05) con una menor supervivencia libre de enfermedad, comportándose, por tanto, como factores de mal pronóstico son los siguientes: tamaño, número de ganglios linfáticos axilares con metástasis, tipo de metástasis ganglionar (peor pronóstico de los casos con metástasis masivas o con invasión extracapsular con respecto a los casos con metástasis focales o sin metástasis), índice de celularidad, índice pronóstico morfométrico multiparamétrico de Baak, índice de Nottingham y estado de p53 (peor pronóstico los casos positivos, figura 1).
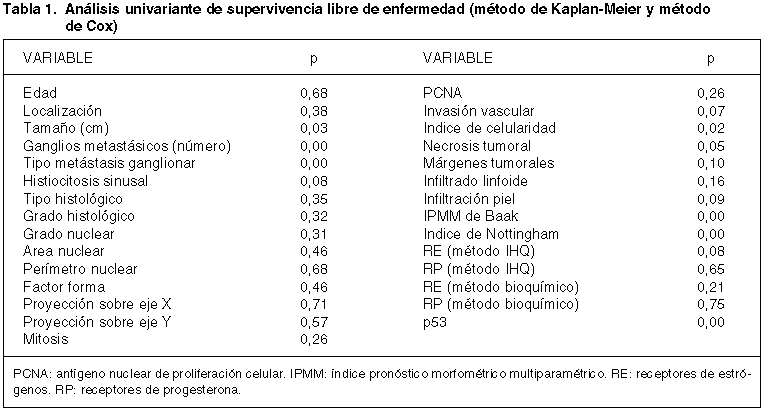

Fig. 1. Comparación
entre las curvas de supervivencia libre de enfermedad de los casos p53 positivos
y p53 negativos.
El mismo tipo de análisis se ha realizado para la supervivencia global, obteniéndose los resultados que se muestran en la tabla II. Los parámetros que se han asociado de forma significativa (p<0,05) con una menor supervivencia global, actuando por tanto como factores de mal pronóstico son los siguientes: tamaño, número de ganglios linfáticos axilares con metástasis, tipo de metástasis ganglionar (peor pronóstico de los casos con metástasis masivas o con invasión extracapsular con respecto a los casos con metástasis focales o sin metástasis), índice de actividad mitótica, índice de celularidad, índice pronóstico morfométrico multiparamétrico de Baak, índice de Nottingham, ausencia de expresión inmunohistoquímica de RE y estado de p53 (peor pronóstico los casos positivos, figura 2).

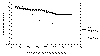
Fig. 2. Comparación
entre las curvas de supervivencia global de los casos p53 positivos y p53
negativos.
Estudio de la dependencia entre las variables con influencia pronóstica (analisis multivariante)
Se ha realizado análisis multivariante utilizando el método de Cox, encontrándose que para la supervivencia libre de enfermedad los parámetros que se comportan como factores de mal pronóstico con significación estadística o valores cercanos a la misma (p<0,10) son el número de ganglios linfáticos axilares con metástasis (1 a 5 ganglios y 6 o más ganglios con respecto a ningún ganglio con metástasis), un índice de celularidad mayor de 100, la presencia de invasión vascular y la positividad de p53. El modelo definitivo de variables predictoras se muestra en la tabla III.

Para la supervivencia global los parámetros que se comportan como factores de mal pronóstico con significación estadística o cercana a la misma (p<0,10) son el número de ganglios linfáticos axilares con metástasis (1 a 5 ganglios y 6 o más ganglios con respecto a ningún ganglio con metástasis), un índice de celularidad mayor de 100, la presencia de invasión vascular y la positividad de p53. El modelo definitivo de variables predictoras se muestra en la tabla IV.
En los dos análisis multivariantes han sido solo cuatro (los mismos en ambos) los factores con influencia pronóstica:
1) El número de ganglios linfáticos axilares con metástasis es el factor con mayor capacidad pronóstica, sobretodo cuando hay 6 o más ganglios con metástasis.
2) El índice de celularidad mayor de 100 es el segundo parámetro en orden de capacidad pronóstica después del número de ganglios metastásicos mayor de 5.
3) La presencia de invasión vascular.
4) La positividad de p53 se comporta como una variable pronóstica, con un riesgo relativo de eventos (recaídas para la supervivencia libre de enfermedad y muertes para la supervivencia global) con respecto a los casos p53 negativos de 2,22 para la supervivencia libre de enfermedad y de 2,68 para la supervivencia global, presentando significación estadística (p=0,03) para la supervivencia global y un valor de p muy cercano a la significación estadística (p=0,053) para la supervivencia libre de enfermedad.
DISCUSIÓN
Nuestros resultados coinciden con los de la mayoría de los trabajos (3,4,29) en cuanto a que la mayor capacidad pronóstica en el cáncer de mama corresponde a la presencia y el número de metástasis linfáticas axilares. Además, hemos encontrado que otros tres factores (la presencia de invasión vascular, el índice de celularidad y la positividad de p53) se han comportado como factores de mal pronóstico independiente.
La importancia de la invasión vascular como factor pronóstico en el cáncer de mama se ha puesto de manifiesto en diferentes estudios (30,31), aunque es controvertida, debido sobretodo a la dificultad de su valoración por los espacios artefactuales producidos por la retracción del tejido alrededor de los nidos de células tumorales, lo que plantea la necesidad de utilizar técnicas inmunohistoquímicas (factor VIII u otros) para detectar los espacios vasculares.
La celularidad tumoral es un parámetro poco estudiado en cuanto a su influencia pronóstica, aunque algunos trabajos indican que se trata de un factor con capacidad pronóstica (31). En nuestra serie el índice de celularidad es el segundo parámetro en orden de capacidad pronóstica después del número de ganglios metastásicos. Pensamos que la capacidad pronóstica del índice de celularidad probablemente esté en relación con la proporción núcleo/citoplasma, considerada tradicionalmente un signo de anaplasia y malignidad. Los tumores con una mayor proporción núcleo/citoplasma presentan un mayor índice de celularidad y ésto podría explicar su comportamiento más agresivo. Nuestros resultados, similares a los de Ambros (31) sugieren que debería incluirse este parámetro en los estudios de supervivencia de cáncer de mama para confirmar de forma definitiva su influencia pronóstica.
El gen supresor p53 es un regulador negativo esencial en el control de la proliferación celular, actuando a través de la proteína p53, la cual se activa en respuesta a radiaciones u otros agentes que alteran el ADN, bloqueándose la replicación del ADN al parar el ciclo celular en G1 y haciendo así posible la reparación del mismo. En caso de que ésta no fuera posible, la proteína p53 induce apoptosis. Cuando el gen p53 está inactivado permite a las células continuar replicándose sin la corrección de las mutaciones del ADN, dando lugar a una inestabilidad genética y a un alto riesgo de acumulación de alteraciones genéticas múltiples, lo que conduce a la aparición de tumores (32). Esta mecanismo de actuación del gen p53 ha llevado a considerarlo como «el guardián del genoma» (33). La inactivación de la proteína p53 es debida a delección o mutación del gen. Las mutaciones, además de ocasionar la pérdida de función del gen, producen una proteína anómala más estable que la hace detectable mediante técnicas de inmunohistoquímica (34), lo que ha llevado a asociar la detección inmunohistoquímica de la proteína con la mutación del gen. En este sentido, numerosos estudios han comparado los hallazgos inmunohistoquímicos con la mutaciones detectadas mediante diversos estudios genéticos (35), observando que la mayoría de los tumores que muestran positividad inmunohistoquímica para p53 presentan mutaciones (8). En el cáncer de mama se han realizado numerosos estudios para la detección de alteraciones del gen p53 a través de técnicas genéticas e inmunohistoquímicas, habiéndose encontrado una frecuencia de alteraciones que oscila entre un 23 y un 48% (11) de los casos (25% en nuestro estudio). La influencia de la expresión inmunohistoquímica de p53 en el pronóstico es controvertida, encontrándose en los diferentes trabajos resultados muy variados, algunos de los cuales asocian la positividad de p53 a un peor pronóstico (8-16,22-24), mientras que otros demuestran que no existe asociación significativa entre el estado de la proteína p53 y la supervivencia libre de enfermedad y/o global (7,17-21,25). Algunos trabajos muestran que la positividad de p53 es un factor de mal pronóstico independiente, con significación estadística en el análisis multivariante, aunque sólo en el grupo carcinomas de mama sin metástasis ganglionares axilares (9,11), mientras que otros (8) muestran que la expresión de p53 es un factor de mal pronóstico para todos los casos, tanto como metástasis ganglionares como sin ellas. Otros estudios encuentran sólo influencia sobre la supervivencia libre de enfermedad (12), y en algunos trabajos el estado de p53 se asocia con la supervivencia en el análisis univariante aunque no en el multivariante (36), lo que indicaría que no es un factor pronóstico independiente y que la su influencia pronóstica dependería de su asociación con otros factores pronósticos. Estas diferencias entre unas y otras series se deben a diversos factores que dificultan la comparación de los resultados entre las mismas, tales como la diversidad de anticuerpos empleados, la variabilidad de criterios de positividad, ya que se ha considerado positivo desde cualquier tinción nuclear por muy escasa y débil que sea a la positividad de más del 10% de los núcleos (37) (que es el criterio más aceptado en la actualidad) y las diferencias en el procesamiento técnico (heterogeneidad en las condiciones de fijación y en las técnicas de desenmascaramiento antigénico). Incluso el tiempo de almacenamiento de las preparaciones antes de realizar el estudio inmunohistoquímico puede influir en los resultados, habiéndose observado que un tiempo superior a dos meses puede causar la pérdida del antígeno, determinando resultados falsos negativos (38,39).
Los diferentes estudios genéticos para la detección de mutaciones del gen p53 también encuentran resultados dispares en cuanto a la influencia pronóstica, habiéndose encontrado en algunos estudios una menor supervivencia en casos con mutaciones del gen p53, con diferencias significativas con respecto a los que no las presentan (40-42), mientras que en otros la presencia de mutaciones no presenta ninguna influencia pronóstica (43). Otros factores, además de los citados, que pueden influir en esta discrepancia entre unos estudios y otros son las diferencias en el tiempo de seguimiento y el hecho de que algunos trabajos tienen un número pequeño de casos. Sin embargo, un meta-análisis que recoge 11 trabajos diferentes (44) concluye que la presencia de mutaciones de p53 es un mal pronóstico independiente.
En la actualidad no existe consenso en cuanto a la necesidad de realizar de forma rutinaria estudios de p53 en el cáncer de mama (26,45). Además no existe acuerdo con respecto a la metodología a emplear (determinación inmunohistoquímica o genética), aunque la mayor disponibilidad de técnicas inmunohistoquímicas en los laboratorios de Anatomía Patológica es un factor importante a tener en cuenta cuando se plantea su determinación de rutina en el cáncer de mama. Es necesario realizar estudios con un número elevado de casos, seguimientos largos y utilizando el mismo anticuerpo y criterio de positividad y un procesamiento técnico similar, así como estudios de tipo meta-análisis basados en las series publicadas para considerar de forma definitiva la inclusión de la determinación inmunohistoquímica de p53 en el estudio patológico clínico de rutina del cáncer de mama.
BIBLIOGRAFÍA
Russo J, Frederick J, Ownby HE y cols. Predictors of recurrence and survival of patients with breast cancer. Am J Clin Pathol 1987; 88: 123-131.
Saigo P, Rosen PP. Prognostic factors in invasive mammary carcinomas 1,0 cm or less in diameter. Am J Clin Pathol 1980; 73: 303-304.
Nemoto T, Vana J, Bedwani R y cols. Management and survival of female breast cancer: result of a national survey by the American College of Surgeons. Cancer 1980; 45: 2917-2924.
Fisher B, Bauer M, Wickerham L, Redmond CK, Fisher ER. Relation of number of positive axillary nodes to the prognosis of patients with primary breast cancer. An NSABP update. Cancer 1983: 52: 1551-1557.
Miller WR, Ellis IO, Sainsbury JRC, Dixon JM. Prognostic factors. Br Med J 1994 Dec; 309: 1573-76.
Silvestrini R, Benini E, Daidone MG y cols. p53 as an independent prognostic marker in lymph node-negative breast cancer patients. J Natl Cancer Inst 1993; 85: 965-970.
Bosari S, Lee AK, Viale G, Heatley GJ, Coggi G. Abnormal p53 immunoreactivity and prognosis in node-negative breast carcinomas with long-term follow-up. Virchows Arch A Pathol Anat Histopathol 1992; 421: 291-5.
Thor AD, Moore DH, Edgerton SM y cols. Accumulation of p53 tumor suppressor gene protein: an independent marker of prognosis in breast cancers. J Natl Cancer Inst 1992; 84: 845-855.
Allred DC, Clark GM, Elledge R y cols. Association of p53 protein expression with tumor cell proliferation rate and clinical outcome in node-negative breast cancer. J Natl Cancer Inst 1993 Feb 3; 85(3): 200-206.
Marks JR, Humphrey PA, Wu K y cols. Overexpression of p53 and HER-2/neu proteins as prognostic markers in early stage breast cancer. Ann Surg 1994; 219: 332-341.
Isola J, Visakorpi T, Holli K, Kallioniemi O-P. Association of overexpression of tumor suppressor protein p53 with rapid cell proliferation and poor prognosis in node-negative breast cancer patients. J Natl Cancer Inst 1992; 84: 1109-1114.
Stenmark-Askmalm M, Stal O, Sullivan S, Ferraud L, Sun X-F, Carstensen J, Nordenskjöld B. Cellular accumulation of p53 protein: an independent prognostic factor in stage II breast cancer. Eur J Cancer 1994; 30A(2): 175-180.
Friedrichs K, Gluba S, Eidtmann H, Jonat W. Overexpression of p53 and prognosis in breast cancer. Cancer 1993; 72: 3641-7.
Barnes DM, Dublin EA, Fisher CJ, Levison DA, Millis RR. Immunohistochemical detection of p53 protein in mammary carcinoma: an important new independent indicator of prognosis? Hum Pathol 1993; 24: 469-476.
Silvestrini R, Benini E, Veneroni S y cols. p53 and bcl-2 expression correlates with clinical outcome in a serie of node-positive breast cancer patients. J Clin Oncol 1996; 14: 1604-10.
Gasparini G, Weidner N, Bevilacqua P, Maluta S, Palma PD Caffo O y cols. Tumor microvessel density, p53 expression, tumor size and peritumoral lymphtyc vessel invasion are relevant prognostic markers in node-negative breast carcinoma. J Clin Oncol 1994; 12: 454-466.
Jacquemier J, Molès JP, Penault-Llorca F, Adélaide J, Torrente M, Viens P y cols. p53 immunohistochemical analysis in breast cancer with four monoclonal antibodies: comparison of staining and PCR-SSCP results. Br J Cancer 1994; 69: 846-852.
Rosen PP, Lesser ML, Arroyo CD Cranor M, Borgen P Norton L. p53 in node-negative breast carcinoma: an immunohistochemical study of epidemiologic risk factor, histologic features and prognosis. J Clin Oncol 1995; 13: 821-830.
Ostrowski JL, Sawan A, Wright HC, Hennessy HC, Lennard TJW, Angus B, Horne CHW. p53 expression in human breast cancer related to survival and prognostic factors: an immunohistochemical study. J Pathol 1991; 164: 75-81.
Pietiläinen T, Lipponen P, Aaltomaa S, Eskelinen M, Kosma V-M, Syrjänen K. Expression of p53 protein has no independent prognostic value in breast cancer. J Pathol 1995; 177: 225-232.
Reed W, Hannisdal E, Boehler PJ, Gundersen S, Host H, Marthin J. The prognostic value of p53 and c-erb B-2 immunostaining is overrated for patients with lymph node negative breast carcinoma: a multivariate analysis of prognostic factors in 613 patients with a follow-up of 14-30 years. Cancer 2000; 88(4): 804-813.
Elkhuizen PH, van Slooten HJ, Clahsen PC, Hermans J, van de Velde CJ, van den Broek LC, van de Vijver ML. High local recurrence after breast-conserving therapy in node-negative premenopausal breast cancer patients is greatly reduced by one course of perioperative chemotherapy: A European Organization for Research and Treatment of Cancer Breast Cancer Cooperative Group Study. J Clin Oncol 2000; 18(5): 1075-83.
Bhatavdekar JM, Patel DD, Shah NG, Vora HH, Suthar TP, Chikhlikar PR, Ghosh N Trivedi TI. Prognostic significance of immunohistochemically localized biomarkers in stage II and stage III breast cancer: a multivariate analysis. Ann Surg Oncol 2000; 7(4): 305-11.
Beenken SW, Grizzle WE, Crowe DR y cols. Molecular biomarkers for breast cancer prognosis: coexpression of c-erbB-2 and p53. Ann Surg 2001; 233(5): 630-8.
Tas F, Yavuz E, Aydiner A, Saip P, Disci R, Iplikci A, Topuz E. Angiogenesis and p53 protein expression in breast cancer: prognostic roles and interrelationships.
Fitzgibbons PL, Page DL, Weaver D, y cols. Prognostic Factors in Breast Cancer. College of American Pathologist Consensus Statement 1999. Arch Pathol Lab Med 2000; 124: 966-978.
Baak JPA, Van Dop H, Kurver PHJ, Hermans J. The value of morphometry to classical prognosticators in breast cancer. Cancer 1985; 56: 374-382.
Frierson HF, Wolber RA, Berean KW, Franquemont DW, Gaffey MJ, Boyd JC, Wilbur DC. Interobserver reproducibility of the Nottingham modification of the Bloom and Richardson histologic grading scheme for infiltrating ductal carcinoma. Am J Clin Pathol 1995; 103: 195-198.
Alderson MR, Hamlin I, Staunton MD. The relative significance of prognostic factors in breast carcinoma. Br J Cancer 1971; 25: 646-655.
Clemente CG, Boracchi P, Andreola S, Del Vecchio M, Veronesi P, Rilke FO. Peritumoral lymphatic invasion in patients with node-negative mammary duct carcinoma. Cancer 1992; 69: 1396-1403.
Lee AKC, DeLellis RA, Silvermann ML, Heatley GJ, Wolfe HJ.
Prognostic significance of peritumoral lymphatic and blood vessel invasion
in node-negative carcinoma of the breast. J Clin Oncol 1990; 8: 1457-1465.
Ambros RA, Trost RC. Cellularity in breast carcinoma. Am J Clin Pathol 1990;
93: 98-100.
Livinstone LR, White A, Sprouse J, Livanos E, Jacks T, Tisty TD. Altered cell cycle arrest and gene amplification potential accompany loss of wild type p53. Cell 1992; 70: 923-935.
Lane DP. p53, guardian of the genome. Nature 1992; 358: 15-16.
Finlay CA, Hinds PW, Tan TH, Aliyahu D, Oren M, Levine J. Activating mutations for transformation by p53 produce a gene product that forms an hsc70-p53 complex with an altered half life. Mol Cell Biol 1988; 8: 531-539.
Tsuda H, Hirohashi S. Association among p53 mutation, nuclear accumulation of the p53 protein and aggressive phenotypes in breast cancer. Int J Cancer 1994; 57: 498-503.
Noguchi M, Kitagawa H, Kinoshita K y cols. The relationship of p53 protein and lymph node metastases in invasive breast cancer. Surg Today 1994; 24: 512-517.
Barbareschi M, Leonardi E, Mauri FA, Serio G, Palma PD. p53 and c-erbB-2 protein expression in breast carcinomas. An inmunohistochemical study including correlations with receptor status, proliferation markers, and clinical stage in human breast cancer. Am J Clin Pathol 1992; 98: 408-418.
Prioleau J, Schnitt SJ. p53 antigen loss in stored paraffin slides. N Engl J Med 1995; 332(22): 1521-22.
Jacobs TW, Prioleau JE, Stillman IE, Schnitt SJ. Loss of tumor marker-immunostaining intensity on stores paraffin slides of breast cancer. J Natl Cancer Inst 1996; 88(15): 1054-9.
Thorlacius S, Börresen A-L, Eyfjörd JE. Somatic p53 mutations in human breast carcinomas in an icelandic population: a prognostic factor. Cancer Res 1993; 53: 1637-41.
Ellegde RM, Fuqua SAW, Clark GM, Pujol P, Allred DC, McGuire WL. Prognostic significance of p53 gene alterations in node-negative breast cancer. Breast Cancer Res Treat 1993; 26: 225-235.
Saitoh S, Cunningham J, De Vries EMG, MacGovern RM, Schroeder JJ, Hartmann A y cols. p53 gene mutations in breast cancers in midwestern US women: null as well as missense-type mutations are associated with poor prognosis. Oncogene 1994; 9: 2869-75.
Caleffi M, Teague MW, Jensen RA, Vnencak-Jones CL, Dupont WD, Parl FF. p53 gene mutations and steroid receptor status in breast cancer. Cancer 1994; 73: 2147-56.
Pharoah PD, Day NE, Caldas C. Somatic mutations in the p53 gene and prognosis in breast cancer: a meta-analysis.
Hamilton A, Piccart M. The contribution of molecular markers to the prediction of response in the treatment of breast cancer: a review of the literature on HER-2, p53 and BCL-2. Ann Oncol 2000; 11(6): 647-63.